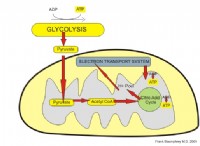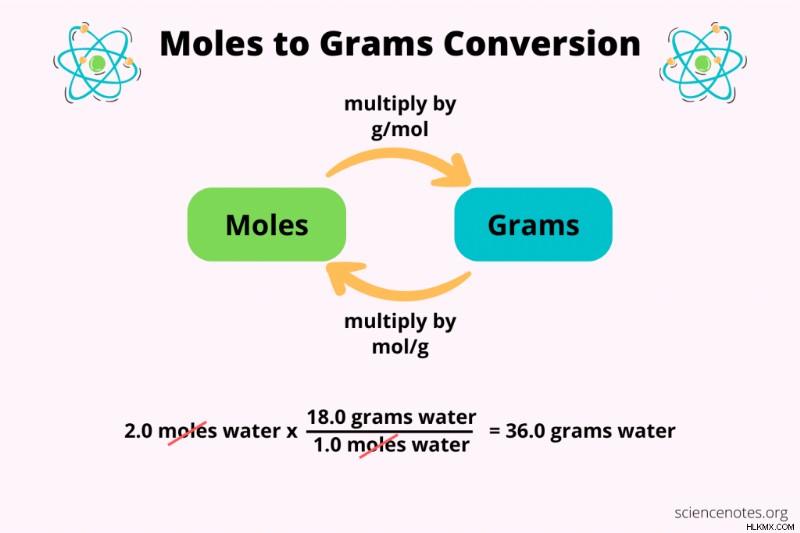
두더지를 그램 또는 그램으로 돌리면 화학에서 항상하는 일입니다. 화학 방정식은 두더지를 사용하여 양의 반응물 및 제품을 관련 시키지만 그램을 사용하는 스케일과 균형에서 화학 물질을 측정합니다. 변환이 쉽고 올바르게 설정할 수 있도록합니다.
몰을 그램으로 변환하는 방법
당신이 필요한 것은 요소의 원자 질량을 찾기위한주기적인 테이블입니다.
그램 =두더지 x 원자 질량
g =mol x (g/mol)
두더지를 그램으로 변환하는 단계는 다음과 같습니다.
- 물질의 두더지 수와 화학적 공식으로 시작하십시오.
- 물질의 몰 질량을 찾으십시오. 각 요소의 원자 질량에 첨자를 곱하십시오. 첨자가없는 경우 해당 요소의 원자 질량을 사용하십시오.
- 몰 질량에 두더지의 수를 곱하십시오. 이것은 그램으로 답을 제공합니다.
몰에 그램 예제 #1
예를 들어, 3.6 몰의 황산 (H 2 그램에서 질량을 찾으십시오. 그래서
먼저, 요소의 원자 질량을 찾으십시오 :
- h =1.008
- s =32.06
- o =16.00
이제 화학 공식을 사용하고 H 2 의 몰 질량을 찾으십시오. 그래서
H 2의 몰 질량 그래서
마지막으로, 몰 질량을 곱한 두더지의 수를 곱하십시오.
3.6 몰의 질량 H 2 그래서
몰에 그램 예제 #2
0.700 몰의 과산화수소 (H2O2)의 질량을 찾으십시오.
이번에는 중요한 수치의 수에주의를 기울입니다. 0.700 몰에 3 개의 중요한 수치가 있습니다.
요소의 원자 질량을 적어 두십시오 :
- h =1.008
- o =15.999
H 2 의 몰 질량을 계산하십시오 o 2 :
H 2의 몰 질량 o 2 =(1.008) (2) + (15.999) (2) =2.016 + 31.998 =34.014 g/mol
이제 그램의 대답을 위해 과산화수소의 몰 질량을 곱하십시오.
H 2 의 그램 o 2 =0.700 몰 x 34.014 그램/몰 =23.810 그램
그램에서 두더지 전환
그램을 두더지로 변환하는 것은 쉽습니다. 다시 한번, 당신은 물질의 어금니 질량을 사용합니다.
몰스 =그램 / 원자 질량
mol =g x mol/g
- 그램 수와 화학 공식으로 시작하십시오.
- 물질의 몰 질량을 찾으십시오.
- 몰 질량으로 질량을 분열하여 두더지에 대한 답변.
예를 들어, 25.0 그램의 칼륨 과망간산염에서 두더지의 수를 찾으십시오 (KMNO 4 . ).
주기율표를 사용하여 요소의 질량을 찾아보십시오.
- k =39.01
- Mn =54.94
- o =16.00
kmno 4 의 몰 질량을 계산하십시오 :
kmno
질량을 그램으로 나누고 몰 질량 (g/mol)으로 나누고 두더지를 얻습니다.
KMNO4의 두더지 =25.0 g/157.95 g/mol =0.158 Moles
참조
- 안드레아스, 버크; et al. (2011). "28SI 결정에서 원자를 세어 아 바가드로 상수의 결정". 물리적 검토 편지 . 106 (3) :30801. doi :10.1103/physrevlett.106.030801
- Barański, Andrzej (2012). “원자 질량 단위, 아바가드로 상수 및 두더지 :이해하는 방법”. 화학 교육 저널 . 89 (1) :97–102. doi :10.1021/ed2001957
- Cooper, G.; Humphry, S. (2010). “단위와 실체의 존재 론적 구별”. 합성 . 187 (2) :393–401. doi :10.1007/s11229-010-9832-1
- 국제 무게 및 측정 국 (2006). 국제 단위 (SI) (8th ed.). ISBN 92-822-2213-6.
- “무게와 측정법 1985 (c. 72)”. 영국 법령 법 데이터베이스. 공공 부문 정보 사무소