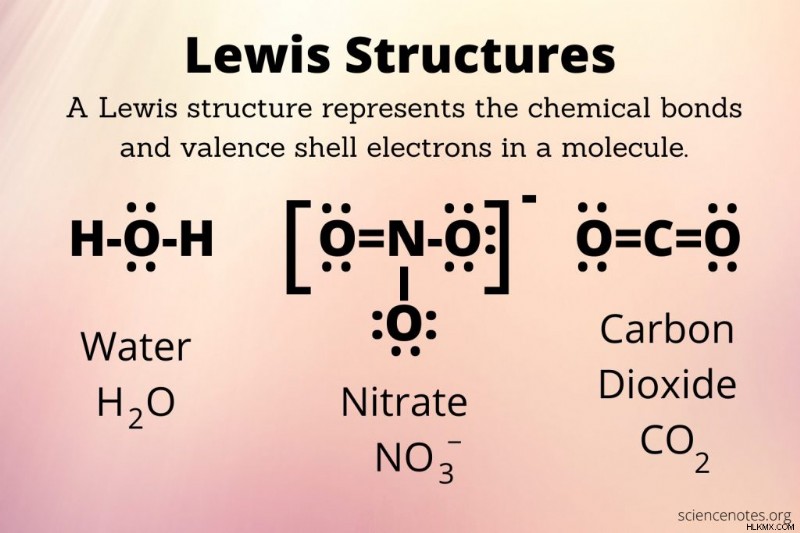
루이스 구조는 분자의 원자와 원자가 전자 또는 고독한 전자 쌍 사이의 화학적 결합을 나타내는 다이어그램입니다. 다이어그램을 Lewis Dot 다이어그램, Lewis Dot 공식 또는 전자 점 도문이라고도합니다. 루이스 구조는 1916 년 기사 원자와 분자 에서 원자가 본드 이론과 도트 구조를 소개 한 길버트 N. 루이스 (Gilbert N. Lewis)의 이름을 가져옵니다. .
루이스 구조는 전자가 원자 주위에 어떻게 배열되는지를 보여 주지만 는 설명하지 않습니다. 전자가 원자 사이에서 공유되는 방법, 화학 결합이 형성되는 방법 또는 분자의 형상이 무엇인지. 다음은 예제와 다이어그램의 중요성과 한계를 모두 살펴 보는 Lewis 구조를 그리는 방법입니다.
루이스 구조의 일부
루이스 구조는 분자와 복합체를 위해 그려집니다. 루이스 구조는 다음 부분으로 구성됩니다.
- 요소 기호
- 원자가 전자를 나타내는 도트
- 화학 결합 (단일 결합의 경우 1 라인, 이중 결합 등의 경우 2 개)을 나타내는 라인
- 점과 선은 옥트 규칙을 만족시킵니다.
- 구조에 순 전하가 들어 오면 괄호는 그것을 둘러싸고 충전은 상위 상부 코너 에 나열되어 있습니다.
참고 :때때로 "Lewis Structure"및 "Electron Dot Structure"라는 용어는 상호 교환 적으로 사용됩니다. 기술적으로, 그것들은 조금 다릅니다. 루이스 구조는 선을 사용하여 화학 결합을 나타내는 반면 전자 점 구조는 점 만 사용합니다.
루이스 구조를 그리는 단계
루이스 구조를 그릴 수있는 단계는 몇 개 밖에 없지만 제대로 얻으려면 시행 착오가 필요할 수 있습니다.
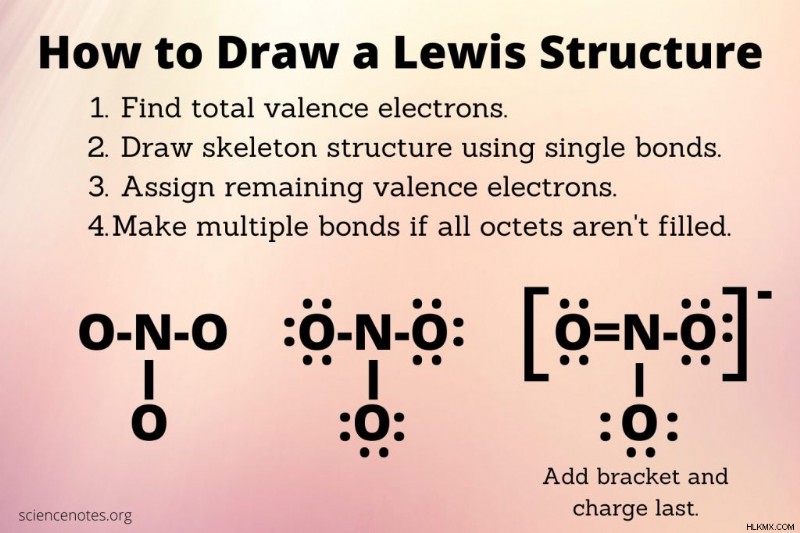
- 분자의 모든 원자에 대한 총 원자가 전자 수를 찾으십시오. 중성 분자의 경우, 이것은 각 원자에서 원자가 전자의 합입니다. 원소에 대한 원자가 전자의 수는 일반적으로 주기성 테이블의 그룹 수와 동일합니다 (헬륨 및 금속 제외). 분자에 전하가있는 경우 각각의 양전하에 대해 하나의 전자를 빼거나 각 음전하에 대해 하나의 전자를 추가하십시오. 예를 들어, no 3 의 경우 , 당신은 질소 원자에 대한 5 개의 전자와 산소 원자에 대한 3 x 6 =18 전자와 순 전하의 1 개의 원자가 전자가 있으며, 총 24 개의 원자가 전자 (5 + 18 + 1)를 제공합니다.
- 분자의 골격 구조를 그립니다. 이 시점에서 원자가 단일 결합으로 연결되어 있다고 가정합니다. 일반적으로 결합 부위가 가장 큰 원자는 중심 원자입니다 (따라서 탄소는 산소에 비해 중심이 될 것입니다.
- 옥트 규칙을 만족시키기 위해 얼마나 많은 전자가 필요한지 결정하십시오. 수소 및 헬륨의 원자가 전자 쉘은 2 개의 전자로 충전된다. 다른 원자의 경우, 주기율표의 기간 4까지, 원자가 쉘은 8 개의 전자로 채워진다. 각 화학 결합은 2 개의 전자가 필요하므로 두 개의 원자가 전자를 사용하여 골격 구조에서 원자 사이에 각 결합을 형성하십시오. no
3 의 경우 , 6 개의 전자를 사용하여 골격에 대한 단일 결합을 그렸다. 따라서 18 개의 전자가 남아 있습니다. 가장 전기 음성 원자로 시작 하여이 전자를 분배하여 원자의 옥셋을 채우십시오. - 나머지 원자가 전자를 배포하십시오. 옥트 규칙을 만족시키기 위해 이러한 비 결합 전자를 원자 주위의 점으로 그립니다.
- 분자에서 화학 결합을 그립니다. 모든 낙지가 채워지지 않으면 이중 채권이나 트리플 본드를 만드십시오. 이렇게하려면 전기 음성 원자에 고독한 전자 쌍을 사용하여 전자가없는 전기 양성 원자와 공유되는 본딩 쌍으로 만듭니다.
- 각 원자에 대해 가장 낮은 공식 전하가 있는지 확인하십시오. 옥트 규칙을 위반하지 마십시오. 공식적인 전하는 원자가 전자의 수, 결합 전자 수의 절반을 빼고 고독한 전자의 수를 뺀 것입니다. 따라서 각 단일 결합 산소에 대해 6 -1 -6 =-1입니다. 질소의 경우 5 - 4 - 0 =+1입니다. 이중 결합 산소의 경우 6 -2 -4 =0입니다. 단일 결합 산소 원자, 1 개의 질소 및 1 개의 이중 결합 산소가 있으므로 순결 전하는 -1 + -1 + 1 + 0 =-1입니다. 공식 요금을 별도로 표시하거나 구조 주위에 브래킷을 그리고 -또는 -1을 슈퍼 스크립트로 추가하십시오. .
루이스 구조를 그리는 다양한 방법
루이스 구조를 그릴 수있는 "올바른"방법은 하나 이상 있습니다. 화학 클래스의 구조물을 그리는 경우 강사가 기대하는 것을 알고 있어야합니다. 예를 들어, 일부 화학자들은 지오메트리를 나타내지 않는 골격 구조를 선호하는 반면, 다른 화학자는 형태를 보는 것을 선호합니다 (예를 들어, 구부러진 물 모양, 비 결합 전자 쌍은 산소 원자의 한쪽에 각도에 비해 전자 쌍을 갖는). 일부는 원자와 전자를 색으로 보는 것을 좋아합니다 (예 :산소와 그 전자는 적색, 탄소 및 원자가 검은 색).
.루이스 구조가 중요한 이유
Lewis 구조는 많은 원자가 원자가 껍질을 채우거나 반 채우기 때문에 원자가, 화학 결합 및 산화 상태를 설명하는 데 도움이됩니다. 구조에 의해 기술 된 거동은 8 개의 원자가 전자를 갖는 가벼운 요소의 실제 거동에 가깝게 근사한다. 따라서 탄소, 수소 및 산소의 행동에 의존하는 유기 화학 및 생화학에 특히 도움이됩니다. 루이스 구조가 반드시 지오메트리를 나타내는 것은 아니지만 기하학, 반응성 및 극성을 예측하는 데 사용됩니다.
루이스 구조의 한계
일부 응용 분야에 유용하지만 Lewis 구조는 완벽하지 않습니다. 분자에 란타나이드 및 액티 나이드와 같은 8 개 이상의 원자가 전자가있는 원자가 포함되어있을 때는 잘 작동하지 않습니다. 무기 및 유기 금속 화합물은 루이스 구조에 의해 기술 된 것 이상의 결합 체계를 사용한다. 특히, 분자 궤도는 완전히 비편화 될 수있다. 루이스 구조는 방향족을 설명하지 않습니다. 가벼운 분자 (O 2 , clo
참조
- iupac (1997). "루이스 공식". 화학 용어의 개요 (“골드 북”) (2 판). 블랙웰 과학 간행물. ISBN 0-9678550-9-8.
- Lewis, G. N. (1916),“원자와 분자”. j. 오전. 화학 Soc . 38 (4) :762–85. doi :10.1021/ja02261a002
- Miburo, Barnabe B. (1993). “비과술 전공을위한 단순화 된 루이스 구조 그리기”. j. 화학 교육 . 75 (3) :317. doi :10.1021/ed075p317
- Zumdahl, S. (2005) 화학 원리 . Houghton-Mifflin. ISBN 0-618-37206-7.