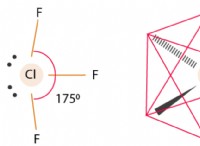
기본 해리 상수 (KB)는 다음과 같이 쓸 수 있습니다
kb =[bh+] [OH] [b]
양쪽에 음으로 기록 된
-logkb =-log [bh] [oh] [b]
⇒ –logkb =-Log [OH] -LOG [BH] [B]
우리는 -log [oh] =poh 및 -logkb =pkb
를 알고 있습니다.
따라서 다음과 같이 방정식을 쓸 수 있습니다.
pkb =poh -log [bh] [b]
방정식을 재정렬하면 Henderson Hasselbalch 방정식을 얻습니다.
⇒poh =pkb + log [bh] [b]
여기
[BH]는 컨쥬 게이트 염기의 몰 농도이고 [b]는 약한 염기의 몰 농도입니다.
Henderson-Hasselbalch 방정식의 한계
Henderson-Hasselbalch 방정식은 강한 염기와 강산에 대한 올바른 값을 예측할 수 없습니다. 이 제한은 공식화에서 몇 가지 가정이 필요하기 때문에 발생합니다. 화학적 평형에서 산 및 그의 컨쥬 게이트 염기의 농도가 공식 농도와 동일하게 유지된다고 가정합니다.
방정식은 물에 의한 자기 탈퇴를 고려하지 않습니다. 따라서 매우 희석 된 버퍼 솔루션에 대한 정확한 pH 값을 제공하지 않습니다.
완충액의 pH 계산을위한 해결 된 예
예 1 : 0.4m CH 3 을 함유하는 완충액 COOH 및 0.6M CH 3 구구. ch 3 의 ka COOH는 1.8 10입니다. 버퍼 솔루션의 pH를 계산합니다.
Henderson-Hasselbalch 방정식에 따르면 pH =PKA + log ([CH 3 COO -]/[ch 3 COOH])
ka =1.8 10
⇒ pka =-log (1.8 10)
=4.7
방정식의 값을 대체 할 때는 다음과 같습니다.
pH =4.7 + 로그 (0.6m /0.4m)
=4.7 + 로그 (1.5)
=4.7 + 0.17
=4.87
따라서 용액의 pH는 4.87입니다.
예제 2 : 아세트산 용액의 pH는 6.75이고 PKA =4.75입니다. 산의 컨쥬 게이트 염기의 비율을 찾으십시오.
Henderson-Hasselbalch 방정식은 다음과 같습니다.
pH =pka + log [a] [ha]
방정식에서 주어진 값을 대체합니다.
6.75 =4.75 + log [a] [ha]
2 =log [a] [ha]
로그 제거시
102 =[a] [ha] =100
따라서 산의 공액 염기의 비율은 상기의 역수, 즉 [ha]/[a] =100.
입니다.
예 3 : pH 5.75의 완충액을 생산해야하고 30.0g의 아세트산이있는 경우. 원하는 pH를 달성하기 위해 어떤 양의 나트륨 아세테이트 (몰)를 추가 하시겠습니까? 아세트산의 PKA =4.75.
Henderson Hasselbalch 방정식 사용 :
pH =pka + log [a] [ha]
이 이온이 동일한 부피를 차지할 것이라고 가정하면
log =[a] [ha] =log [mol of a] [mol of ha]
아세트산의 공식을 사용하여, 우리는 아세트산의 몰 질량이 60 g/mol이기 때문에 30g의 아세트산이 0.5mol과 동일하다는 것을 알고 있습니다.
.
따라서 위의 값을 사용하여 다음 방정식을 얻습니다.
5.75 =4.75 + 로그 [A] [0.5]
위의 방정식을 a에 대한 수정, 우리는 5 mol을 얻습니다.
따라서, 완충 용액에서 원하는 pH에 도달하려면 5 몰의 아세트산 나트륨이 필요할 것이다.
예제 4 : 히드로 플루오르 산 용액은 0.3m 농도를 갖는다. HF의 KA는 7.2 * 10입니다. 이 용액에 수산화 나트륨을 천천히 첨가하면 용액의 pH는 절반 동등성 지점에 있습니까?
Henderson-Hasselbalch 방정식을 사용하면 산과 기본 몰량을 모두 사용하는 것에 대해 걱정할 필요가 없습니다. 절반 등가 지점에서의 접합체 염기의 농도는 약산의 농도와 동일하며 방정식을 쉽게 단순화 할 수 있습니다.
Henderson-Hasselbalch 방정식은 다음과 같습니다.
pH =pka + log [a]/[ha]
절반 등가 점에 대한 위의 방정식을 단순화 할 때 :
pH =pka
따라서 pH는 산 해리 상수와 동일합니다.
하이드로 플루오르 산에 대한 산산 해리 상수가 주어지기 때문에, 절반 등가 지점의 pH는 다음과 같이 계산 될 수있다 :
.
pH =-Log [7.2 * 10]
pH =3.14
따라서, 절반 등가 지점에서 용액의 pH는 3.14입니다.
Henderson Hasselbalch 방정식을 해결할 때 기억해야합니다.
- PKA가 아직 제공되지 않은 경우 PKA를 선택하십시오.
- 양수와 음수에 특별한주의를 기울이십시오.
- pH는 항상 용액에서 수소 이온 농도의 음의 로그와 같습니다.
- 산의 절반 만 해리되면 [a]/[ha]의 값은 1입니다.
|
Henderson Hasselbalch 방정식 계산기
온라인 Henderson Hasselbalch 계산기를 사용하여 pH를 계산할 수도 있습니다. 프로세스와 관련된 단계는 다음과 같습니다.
1 단계 :입력 필드에서 컨쥬 게이트 산/염기성 농도 및 해리 상수를 입력하십시오.
2 단계 :그런 다음 결과를 얻으려면 "ph 계산"버튼을 클릭하십시오.
3 단계 :마지막으로, 완충 용액의 수소 이온 농도는 출력 필드에 제공됩니다.
결론
Henderson Hasselbalch 방정식은 완충액의 pH를 계산하는 데 유용한 공식입니다. 산과 염기 모두에서 작동합니다. 방정식은 특정 pH와 완충액을 준비하기 위해 결합 해야하는 산 및 컨쥬 게이트 염기의 양을 계산하는 데 도움이됩니다.
방정식은 산 및 컨쥬 게이트 염기 평형 농도가있을 때 유효합니다. 강산 또는 염기를 함유하는 용액의 경우, 평형 농도는 중화 화학량 론에 의해 제안 된 것들과는 거리가 멀다.
자주 묻는 질문
Q1. 강력한 기지는 무엇입니까?
강력한베이스는 완전히 이온입니다. 예를 들어, 수산화 칼륨 및 수산화 나트륨은 강한 염기입니다. 강한 염기는 수산화 나트륨 분리가 해리되도록 강한 염기가 수산화 이온 및 금속 이온으로 100% 분할 된 것으로 생각됩니다.
. Q2. KA와 PKA의 차이점은 무엇입니까?
KA는 산 분리 상수이며 PKA는 그 -log입니다. 마찬가지로, KB는 기본 해리 상수이며, PKB는 -log입니다. 이 산 및 염기 해리 상수는 리터당 두더지 (mol / l)로 발현됩니다.
Q3. Henderson Hasselbalch 방정식을 사용하여 어떤 산과 염기의 pH를 측정 할 수 있습니까?
방정식은 산 및 염기의 pH의 근사치 일뿐입니다. 강력하거나 집중된 솔루션에 사용해서는 안됩니다. 또한 매우 낮은 pH 산 또는 높은 pH 염기에는 적합하지 않습니다.