수화물로 알려진 염은 결정 구조에 포함 된 물 분자를 함유한다. 수화 된 소금을 가열하면 포함 된 물이 증발시킬 수 있습니다. 생성 된 결정을 무수라고하며 물이없는 것을 의미합니다. 무수 및 수화 염의 질량 차이는 수화물에서 물의 백분율을 찾는 데 필요한 정보를 제공합니다. 이미이 실험을 수행하고 수화 된 소금과 무수 염의 질량을 알고 있다면 계산은 간단합니다.
- 연필
- 종이
- 계산기
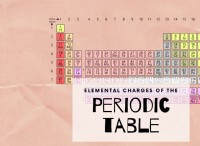
- 주기 테이블
수화 된 소금의 무수 염의 질량을 빼십시오. 예를 들어, 구리 (II) 설페이트 샘플이있는 경우, 가열하기 전에 25 그램, 후 16 그램을 16 그램으로 한 경우 25에서 16을 빼고 9 그램을 얻습니다.
이 차이를 수화 된 소금의 질량으로 나눕니다. 예를 계속하면서, 우리는 9 그램을 25 그램으로 나누어 36 %를 얻을 것입니다. 이것은 수화물의 물의 백분율이므로 계산해야 할 첫 번째 것입니다. 그러나 다른 정보도 계산할 수 있습니다.
주기율표를 사용하여 무수 염의 몰 질량을 결정하십시오. 주기율표에는 각 요소의 몰 질량이 나와 있습니다. 화합물의 각 요소의 몰 질량에 화합물의 몰 질량을 얻기 위해 화합물에 나타나는 횟수를 곱하십시오.
.예를 들어, 무수 구리 (II) 설페이트의 화학적 공식은 Cu (so 4 입니다. ). 이 화합물의 몰 질량은 구리의 몰 질량 + 황의 몰 질량과 같은 산소의 몰 질량 (분자에 4 개의 산소 원자가 있기 때문에)과 동일하다. 주기율표에서 각각의 어금니 질량을 찾으면 다음을 찾을 수 있습니다.
63.55 + 32.06 + (4 x 16) =몰당 159.61 그램
무수 (가열 된) 염 샘플의 질량을 무수 화합물의 몰 질량으로 나누어서, 합성의 몰의 수를 얻는다. 이 예에서, 두더지 당 16 그램 / 160 그램 =0.1 몰.
물의 몰 덩어리로 소금을 가열했을 때 손실 된 물의 덩어리를 두더지 당 약 18 그램으로 나눕니다. 이 예에서는 9 그램의 물을 잃었습니다. 우리가 9를 18으로 나누면 0.5 몰의 물이 손실됩니다.
손실 된 물의 수를 무수 염의 두부 수로 나누어 수분 분자 대 포뮬러 단위의 비율을 얻습니다. 이 예에서, 0.5 몰의 물 ÷ 0.1 몰 구리 황산염 =5 :1 비. 이것은 CUSO4의 모든 단위에 대해 5 개의 분자의 물이 있음을 의미합니다.