원자의 이온화 에너지를 계산하는 것은 많은 현대 기술의 기초가되는 현대 물리학의 일부를 구성합니다. 원자는 양으로 하전 된 양성자 및 주어진 원자에 특이적인 다수의 중성자를 함유하는 중심 핵으로 구성됩니다. 다수의 음으로 하전 된 전자는 다양한 거리에서 핵을 공전합니다. 중심 양성자의 영향으로부터 가장 낮은 궤도 전자를 제거하는 데 필요한 에너지는 이온화 에너지입니다. 덴마크 물리학자인 Niels Bohr는 1913 년 에이 에너지를 1913 년에 계산하여 노벨상을 수상했습니다.
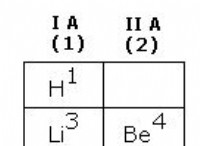
- 이온화 에너지 계산에 사용하려는 원자를 결정하십시오. 주기율표를 사용하여 원자에 대한 "z"값을 식별하십시오. (숫자 z의 다른 이름은 원자 번호입니다.) z의 값은 원자의 기호 위에 나타납니다. 예를 들어, z는 수소의 경우 1과 같습니다.
- 원자에 포함 된 전자 수를 결정하십시오. 이 숫자는 원자가 이미 일부 전자를 잃지 않는 한 z와 동일합니다.
- z를 제곱 한 다음 그 결과를 13.6으로 곱하여 1 전자 원자에 대해 전자 볼트 단위로 이온화 에너지를 계산합니다.
- 하나 이상의 전자를 갖는 원자의 경우, 전자 볼트 단위로 이온화 에너지에 도달하고, 먼저 z에서 하나를 빼고, 답을 쪼개고, 마지막으로 13.6을 곱하여 전자 볼트의 단위로 도달합니다.
예를 들어, 아래 비디오를보십시오 :