에너지 호의
반응물의 농도는 항상 중요합니다. 특히 속도 결정 단계에서 반응물. 반응은 그렇게하는 것이 활발하게 유리할 때 진행됩니다. 평형 반응에서, 생성물에 대한 반응물의 농도는 를 변화시킨다. 반응의 G; 제품 당 더 많은 반응물이있는 반응물과 제품에 대한 반응물의 비율이 불균형이되면 g는 엔트로피에 의해 낮아집니다.
화학자들은 이러한 요소들이 반응을 유발한다고 말할 것이라는 점에 주목하는 것이 중요하지만, 에너지 호의는 속도 결정 단계 과 관련이 없습니다. . G는 반응 속도에 대해 아무것도 말할 수 없습니다. 동시에, 그것은 요금 제한 단계에 대해 아무것도 말할 수 없습니다.
속도 결정 단계는 얼마입니까?
반응에서 가장 긴 시간이 걸리는 단계입니다. 반응 메커니즘의 가장 느린 부분이며 전체 반응이 얼마나 빨리 발생하는지를 결정합니다.
속도 결정 단계와 활성화 에너지 간의 관계
속도 결정 단계를 어떻게 결정합니까? 모든 반응이 발생하기 위해서는 반응물이 활성화 에너지를 극복해야합니다. 이 활성화 에너지는 제품 또는 키 중간체를 형성하는 데 필요한 결합을 깨뜨리는 데 필요한 에너지의 양과 같습니다. 속도 결정 단계는 최고 활성화 에너지와의 반응입니다 반응 메커니즘에서.
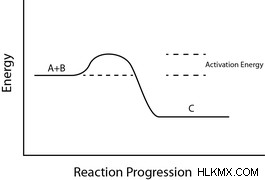
활성화 에너지에 영향을 미치는 몇 가지 요소 만 있습니다. 위에서 언급 한 바와 같이, 결합을 파괴하는 데 필요한 에너지는 활성화 에너지의 주요 요인입니다. 또한, 안정적인 결합을 깨뜨려 불안정한 결합을 형성하면 불안정한 중간체를 형성 할 것입니다. 이들 불안정한 중간체의 형성은 에너지 적으로 바람직하지 않으며 일반적으로 활성화 에너지가 가장 많을 것이다.
그러나, 입체 방향은 또한 반응의 활성화 에너지에 영향을 줄 수있다. 입체 방향은 분자 내의 원자가 다른 분자의 원자뿐만 아니라 서로를 격퇴한다는 생각입니다. 본질적으로, 덜 전기 음성 분자에 대한 다른 결합의 존재는 항체 궤도를 부분적으로 차단한다. 충돌 이론에 의해 표지 된 바와 같이, 반 결합 궤도가 부분적으로 차단되면, 입체적 방해물의 존재 하에서 반응이 느려질 것이다.
.여러 활성화 에너지
유기 화학 내에서, 우리는 많은 반응의 곡선 화살표 메커니즘을 배웠습니다. 이 곡선 화살표는 분자가 반응이 발생하기 위해 형성 될 중간체를 나타냅니다. 유기 화학에서 보았 듯이, 대부분의 반응에는 Diels-Alder 반응과 같은 화살표가 없습니다. 대신, 대부분의 반응은 제품에 도착하기 전에 하나 또는 많은 중간체를 형성합니다. 이들 중간체 각각의 형성은 각각의 활성화 에너지를 갖는다.
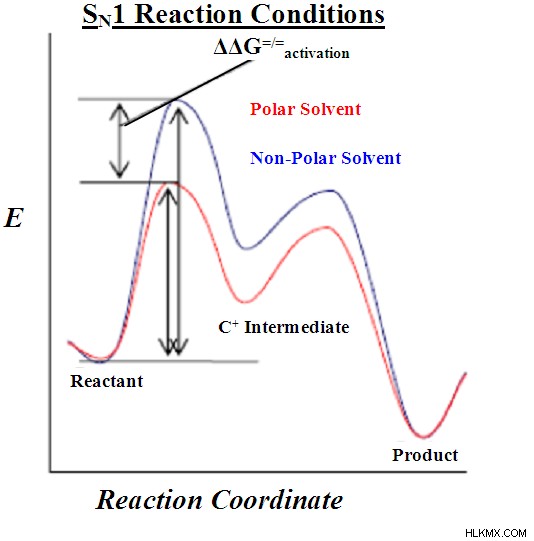
위는 SN1 반응의 에너지 프로파일입니다. 알 수 있듯이, 탄수화물 중간체의 형성은 생성물을 형성하는 반응과는 별도로 자체 활성화 에너지를 갖는다. 우연히도, 반응 의이 단계는 또한 에너지 프로파일에서 가장 높은 활성화 에너지를 갖기 때문에 속도 제한 단계입니다.
에너지 프로파일의 결정 단계
에너지 프로파일의 속도 결정 단계는 활성화 에너지가 가장 높은 것입니다. 에너지 프로파일은 모든 중간체 및 생성물의 형성을위한 활성화 에너지를 제공 함으로써이 단계를 산출 할 것이다. 일반적으로 말하면, 가장 불안정한 중간체를 형성하는 단계는 반응 속도를 결정합니다.
속도 결정 단계 예
탄수화물 또는 enolates (LDA의 사용없이)와 같은 중간체의 형성은 엄청나게 활력 적으로 불리하며 일반적으로 매우 구체적인 조건 하에서 만 진행됩니다. 일반적으로, 생성물이 속도 제한 단계이기 때문에 우수한 친핵체 또는 전기성을 생성하는 반응 또는 반응 메커니즘의 일부.
.반응의 반응 단계 결정
반 반응에서, 여러 번 코스는 반 반응을“느린”것으로 묘사합니다. 이 느린 반응은 속도 결정 단계입니다. 또 다른 옵션은 곡선 화살표 메커니즘을 분리하는 것입니다. 불안정한 중간체가 생성되는 위치를 식별하면,이 반응은 속도 제한 단계 일 가능성이 높습니다.
.속도 결정 단계 및 반응 속도
속도 결정 단계가 확인되면 단계에 관여하는 반응물은 속도 법률 방정식의 분자입니다. 화학자들은 반응의 비율 법 방정식을 실험적으로 계산하고 결정할 수 있습니다. 반응물 순서의 식별자는 없습니다. 요금 법 방정식을 알기 위해 다양한 농도로 3 가지 반응을 실행하고 반복 생활을 측정하십시오.
또한 속도 상수는 실험 조건에 따라 다릅니다 온도와 같은. 이러한 환경 요인의 변화는 반응의 속도 상수에 영향을 미칩니다.