열 화학의 핵심 개념
열 화학은 열에 대한 이해와 열 반응에 어떻게 관여하는지 연구합니다. 중요한 열 화학 방정식은 열과 세계와의 상호 작용을 안내합니다. 열 화학의 중심 개념, 몇 가지 중요한 공식 및 열 화학 문제 해결 방법에 대해 알아보십시오.
열 화학이란 무엇입니까?
열 화학은 다양한 반응에 관련된 열을 연구하는 화학의 분야입니다. 열은 에너지의 한 형태입니다. 열로 인한 에너지는 화학 반응을 주도하거나 반응에서 방출 될 수 있습니다! 열 화학은 반응의 에너지를 이해하고 설명하려고 시도합니다.
"Thermo"는 열과 관련된 것을 의미합니다. "화학"은 분자와 반응에 대한 연구입니다. 따라서 열 화학은 화학의 열입니다.
식품 화학은 열 화학이 일반적인 연구 인 화학의 한 가지입니다. 우리 몸이 설탕과 지방을 분해하면 에너지를 만듭니다. 열 화학은 이것을 설명하는 데 도움이 될 수 있습니다. 또한 얼음 큐브가 따뜻한 물 한 잔을 식히는 방법이나 석탄이 어떻게 전력망을 실행하기 위해 에너지를 공급할 수 있는지 설명하는 데 도움이 될 수 있습니다.
열 화학과 관련된 다른 기사
- 흡열 대 발열 반응
- 반응, 형성 및 연소의 엔탈피
- 열역학 법칙
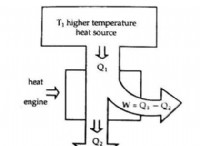
열역학의 첫 번째 법칙
열역학의 첫 번째 법칙은 에너지 보존 법칙이라고도합니다. 즉, 에너지를 만들거나 파괴 할 수 없으며 형태 만 변경됩니다. 보다 정확한 용어로, 열역학의 첫 번째 법칙에 따르면 시스템의 총 에너지 변화는 시스템에 의해 수행 된 작업을 뺀 시스템에 추가 된 열과 관련이 있다고합니다. 이 시스템의 열 연구는 열 화학 연구가 될 것입니다.
반응 방정식의 열 (일명 반응 엔탈피)
반응 엔탈피라고도하는 반응의 열은 반응에서 발생하는 전반적인 열 에너지를 살펴 봅니다. 이것은 반응이 발생함에 따라 물질에 흡수되는 열, 흡열 또는 반응이 발생함에 따라 방출 된 열이 발열 성을 포함한다. (흡열 대 발열 반응에 대한 설명)
ΔH =σ Δ H 제품 - σ Δ H 반응물
- ΔH :엔탈피
- σ Δ H 제품 :제품에 의해 흡수/방출되는 열의 합
- σ Δ H 반응물 :반응물에 의해 흡수/방출되는 열의 합의
예 :
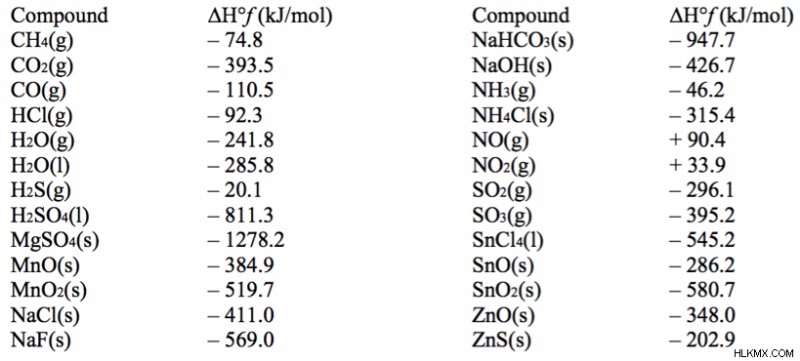
다음을 고려하십시오. naoh (s) + hcl (g) -> naCl (s) + h 2 0 (g) ΔH =?
ΔH = ΔH <서브> 제품 - ΔH 반응물 =(-411.0 + -241.8) -(-426.7 + -92.3) =-682.8 + 519 =-163.8 kj/mol
칼로리 측정
열량 측정법은 시스템과 주변 환경 사이에서 발생하는 에너지 변화를 연구합니다. 이 시스템은 화학 반응을 겪고있는 물질을 나타냅니다. 손의 주변 환경은 시스템과 상호 작용하는 다른 모든 것을 나타냅니다. 교정 된 도구 인 열량계는 이러한 에너지 변화를 측정합니다. 열량계는 더 넓은 환경에서 내부에서 발생하는 반응을 분리합니다. 전형적인 가정의 예에는 스티로폼 컵 사용이 포함됩니다. 여기서 재료는 외부에서 컵의 내용물 사이의 열 상호 작용을 줄입니다.
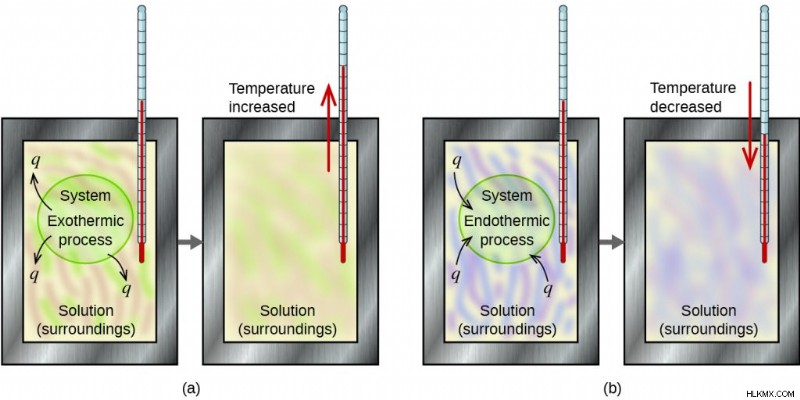
위의 이미지의 이해에서 이상적인 완벽한 세계에서 흡수 된 열은 항상 방출 된 열과 동일합니다. 에너지 보존 법칙에 의해 폐쇄 열량계 내의 총 열 교환은 0입니다.
다시 말해, Q
중요한 열 화학 방정식
열 용량 (c)
모든 물질의 열 용량은 온도 변화 중에 흡수하거나 방출 할 수있는 열량 (Q)을 설명합니다.
C =Q/ΔT
비열 용량 (C)
비열 용량은 물질 1 그램의 온도를 1도 늘리는 데 필요한 열량을 나타냅니다.
c =q/mΔt
물질의 비열 용량은 물질이 얼마나 좋은지를 결정합니다. 예를 들어, 물은 비열 용량이 높습니다. 하루 종일 바다에서 태양이 뛰지만 해수는 온도를 극적으로 바꾸지 않습니다. 물이 비열 용량이 낮 으면 하루 종일 태양 에너지로 바다가 뜨거워지고 에너지가 공중으로 사라짐에 따라 밤새 극적으로 식 힙니다. 이 물 속성은 지구상의 삶의 핵심입니다.
추가 읽기
열 화학 :열과 엔탈피