핵심 개념
이 튜토리얼에서는 산 해리 상수 (KA)와 화학의 다른 주제에 대한 적용에 대해 배웁니다. KA와 PKA를 연관시키는 방법뿐만 아니라 KA와 PH의 관계를 배웁니다.
다른 기사에서 다루는 주제
- 버퍼 용량 및 계산
- 어금니 및 몰이 형식을 계산하는 방법
- 물의 물리적 및 화학적 특성
- 평형 상수는 무엇입니까
- 산성 염기 중화 반응
KA는 무엇입니까?
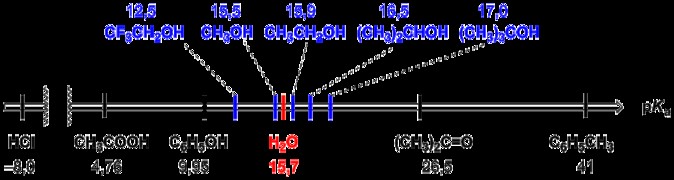
KA 또는 산 해리 상수는 강한 산을 분화시키는 데 사용됩니다. 산이 물에 분리 될 가능성이 적 으면 KA의 값이 더 많이 분리되고 그 반대가 더 낮아지면 KA 값은 적을 것입니다. 따라서, 예를 들어, 강한 염산 (HCL)과 같은 강산은 약산 지수산 (HF)보다 더 높은 해리 상수 Ka를 가질 것이다. 이것은 약산이 물에서 이온화 가능성이 적기 때문에, 주로 분자로 존재하는 반면, 강산은 대부분 물의 이온으로 존재할 것입니다.
.KA는 또한 산의 해리 반응의 평형 상수입니다. 이것은 용액에서 산의 강도에 대한 정량적 값입니다. 산 해리 상수는 단위가 없습니다.
ka는 반응물의 제품과 동일합니다 .
ka 계산 단계
ka를 계산하는 단계는 다음과 같습니다.
- 해리 된 이온의 농도의 산물을 가져 가라. 그런 다음이 숫자를 시작 산의 농도로 나눕니다. 이것을 기억하는 쉬운 방법은“반응물 오버 제품”입니다.
전. hbr → h+ br
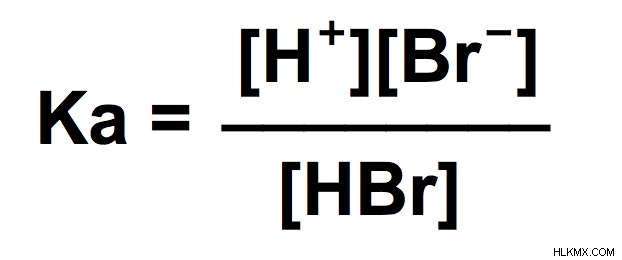
수소 이온, 브로 민 이온 및 수경 산 주변의 괄호는 몰토리를 나타냅니다. 따라서이 반응의 KA에 대한 정량적 값을 찾으려면 각 항목의 몰토리가 필요합니다.
본질적으로, KA의 값이 높을수록 산이 더 해리 될 것이다. 산이 더 많이 분리 될수록 산이 더 강해집니다. 산이 강할수록 KA 값이 높아집니다. 대조적으로, 약한 산은 일반적으로 강한 산보다 KA 값이 낮을 것이다. 왜냐하면 약산은 부분적으로 분리하기 때문이다.
평형 값 (k 값)
반응의 평형 값은 반응의 생성물 사이의 비율을 반응물로 나눈 값을 묘사합니다. 반응에 대한 k 값이 높으면 반응은 생성물에 유리하고 서문 방향으로 진행됩니다. 마찬가지로, 반응의 k 값이 낮 으면 반응이 반응물을 선호하고 후진 방향으로 진행할 것이다.
산-염기 반응
산-염기 반응의 KA는 반응물 및 생성물의 PKA 값을 알고 있다면 계산 될 수있다. 컨쥬 게이트 산 및 반응물 산의 PKA 값 차이의 힘으로 10을 높이십시오.

반응이 약한 접합체 산 및 강한 반응물 산을 갖는 경우, 평형 상수가 높을 것이다. 이것은 반응이 대부분 완성 될 것임을 의미합니다. 반대로, 산-염기 반응이 그의 컨쥬 게이트 산과 강산을 가리면, 평형 상수는 엄청나게 낮을 것이다.
ka에서 pH 계산
산 해리 상수 값은 여러 다른 시나리오에서 사용될 수 있으며, 경우에 따라 pH를 계산하는 데 사용될 수 있습니다. 0.20m의 HBR 솔루션의 예를 사용해 봅시다.
.- 첫 번째 단계는 H 이온을 형성하는 이온화에 대한 화학 반응을 작성하는 것입니다 - hbr ⇌h+ br
- 두 번째 단계는이 반응에 대한 평형 발현을 작성하는 것입니다.이 반응물의 제품입니다.
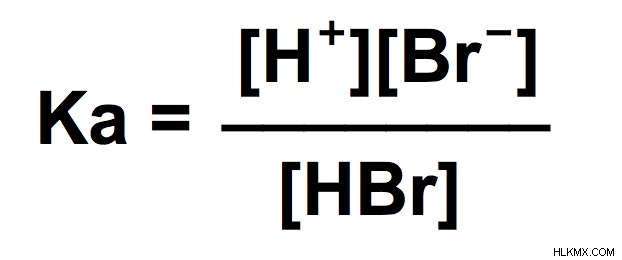
- 다음으로, 우리는 알려진 것을 사용하여 Ice 를 만들어야합니다. 수소 이온의 농도를 해결하기위한 차트.
| 초기 | 0.20 m | 0 | 0 |
| 변경 | -x | +x | +x |
| 평형 | (. 20 - x) m | x | x |