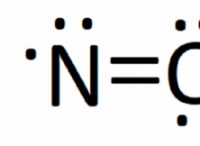핵심 개념
이 튜토리얼에서는 버퍼 용량이 무엇인지, 계산 방법을 배웁니다. 우리는 또한 예제 문제의 연습을 제공 할 것입니다.
다른 기사에서 다루는 주제
- 버퍼 솔루션이란 무엇입니까?
- 산 기본 화학
- pH는 무엇입니까? pH 공식 및 방정식
- 약산 및 약한 염기
버퍼 용량이란 무엇입니까?
버퍼는 pH의 변화에 내성이 있지만 무적은 아닙니다! 충분한 산이나베이스를 완충제에 첨가하면 pH가 극적으로 변할 것입니다.
이것이 왜 발생하는지 이해하기 위해 완충액이 약산이고 공액 염기 (또는 약한 염기 및 접합 된 산)임을 기억하십시오. 아세트산과 그 접합 된 염기, 아세테이트와 같은 완충제의 예를 살펴 보겠습니다.
ch 3 cooh (aq) ⇄ ch 3 coo (aq) + h (aq)
여기서, 우리가 완충제에 산을 첨가 할 때, 아세테이트는 첨가 된 양성자 (H+)를 흡수하고 아세트산을 형성하여 용액의 H+ 농도를 방지하고 결과적으로 pH가 너무 많이 변하지 않도록한다. 마찬가지로, 완충제에 염기를 첨가 할 때, 아세트산은 염기와 반응하여 아세테이트 및 물을 형성하여 OH 농도의 증가를 방지합니다.
그러나, 이들 아세트산 및 아세테이트는 유한 자원이다. 우리가 많은 산이나 염기를 첨가 할 때, 그들은 완충액의 모든 아세트산과 아세테이트를 사용하여 완충액이 극적인 pH 변화에 취약하게 만듭니다.
.버퍼 용량은 PH가 극적으로 변하기 전에 버퍼에 추가 할 수있는 산 또는 염기의 양입니다 . 용량이 높을수록 PH가 크게 변하기 전에 더 많은 산과베이스를 추가 할 수 있습니다.

버퍼 용량의 일반적인 추세
약산의 농도가 높을수록 완충액이 보유한 접합체 (또는 약한 염기 및 컨쥬 게이트 산)가 높을수록 용량이 높아집니다. 예를 들어, [약산] =0.50 m ([]는 농도를 나타내는) 및 [접합체베이스] =0.30m 인 완충제는 [약산] =0.050 m 및 [접합체베이스] =0.030 m을 갖는 완충액보다 더 높은 용량을 갖습니다.
.완충액이 접합체 염기의 약점보다 더 큰 농도가 더 높으면 추가 된베이스의 용량이 더 높아집니다.
마찬가지로, 완충액이 약산보다 접합체 염기의 농도가 더 높으면 산에 대한 내성이 더 높을 것이다. 20 :1의 중탄산염 대 탄산산의 혈액은 이러한 유형의 완충제의 훌륭한 예입니다.
버퍼 용량을 계산하는 방법?
보다 엄격한 용어로, 완충 용량은 1 리터의 완충액에 첨가되어 PH가 1 개의 단위로 변경되도록하는 산 또는 염기의 두더지 수로 정의된다.
.따라서 버퍼 용량을 계산하기 위해 다음 공식을 사용합니다.
β =n / Δph
- β는 완충 용량입니다 (단위가 없음)
- n은 완충액의 리터당 산 또는 염기 (완충액에 첨가 된)의 두더지 수입니다
- Δph는 산 또는 염기가 첨가 된 후 완충액의 초기 pH와 완충액의 pH의 차이 입니다.
버퍼 용량의 문제
문제 :
우리는 pH 7.39 인 600 ml의 나트륨 포스페이트 완충액을 제공합니다. 그런 다음 150 ml의 0.2 m HCl을 첨가하여 버퍼 용액에 새로운 pH 7.03을 제공합니다. 인산 나트륨 완충액의 용량은 얼마입니까?
솔루션 :
먼저, 우리는 버퍼에 추가 된 HCL의 몰의 수를 버퍼의 초기 부피 (리터, 잊지 말고!)로 나누어 N을 발견합니다.
.HCL의 두더지 수 =0.2 m × 0.150 l =0.03 mol
n =0.03 몰/0.600 l =0.05 mol/l
그런 다음, 공식에 따라, 우리는 N을 포스페이트 나트륨 용액의 pH의 변화로 나눕니다.
.Δph =| 7.03 - 7.39 | =0.36
β =0.05 mol/l/0.36 =0.14
따라서, 우리의 인산 나트륨 용액의 완충 용량은 0.14입니다.
추가 판독
- Henderson-Hasselbalch 방정식
- 강산 및 염기
- 모노 프 로스틱, 트리 프로토 및 다발성 산