핵심 개념
이 튜토리얼에서는 단백질 폴딩 이유를 알게됩니다 단백질이 어떻게 기능하는지에 중요합니다. 또한 단백질이 4 가지 수준의 단백질 구조를 설명하는 방법을 배울 것입니다.
단백질 폴딩은 단백질 기능
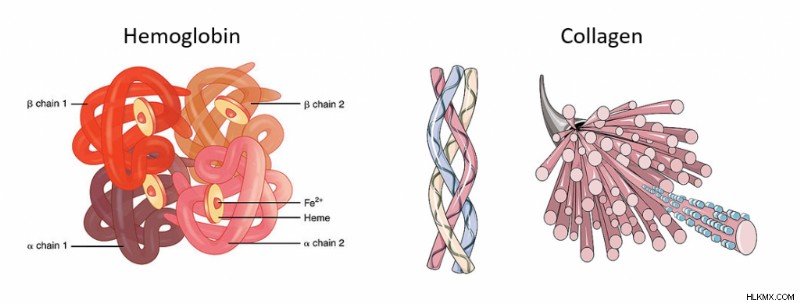
에 중요합니다단백질 폴딩은 단백질이 그 모양을 취하는 과정입니다. 많은 생물학 과정에서, 그것은 종종 구조 =기능으로 표시되며 단백질도 예외는 아닙니다. 예를 들어, 단백질 헤모글로빈은 신체를 통해 산소를 운반 할 수있는 특정한 형태를 취하며, 단백질 콜라겐은 피부가 탄력을 유지할 수있는 다르지만 여전히 중요한 구조를 가지고 있습니다. 단백질이 취하는 모양은 그것이 행동하는 방식에 매우 중요합니다.
구조를 통한 단백질 폴딩 설명
단백질 구조의 수준
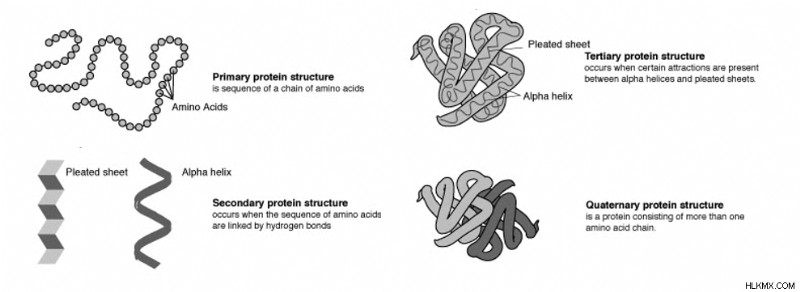
단백질 구조의 4 가지 수준은 단백질을 설명합니다. 가장 기본적인 것은 1 차 구조이며, 아미노산 사슬을 설명합니다. 보조 구조는 알파 나선과 베타 주름 시트의 두 가지 중요한 구성의 형성을 설명합니다. 3 차 구조는 단백질이 접는 방법, 즉 단백질의 2 차 구조 및 구조화되지 않은 영역이 어떻게 상호 작용하는지보다 광범위하게 설명합니다. 4 차 구조는 다수의 단백질 사슬이 서로 상호 작용하는 방식을 설명합니다.
1 차 서열
단백질 구조의 주요 수준은 가장 기본적이지만 단백질이 취할 모양에 필수적입니다. 단백질의 1 차 서열은 다른 모든 수준의 단백질 구조에 영향을 줄 수있다. 단백질의 서열의 아미노산이 변하면 단백질이 모양을 잃거나 변화 할 수 있습니다.
2 차 구조
단백질의 2 차 구조는 접힌 단백질의 주요 특징 인 알파 나선 및 베타 주름 시트를 설명합니다. 이 두 구조 모두 수소 결합을 포함하지만 수소 결합이 형성되는 곳에서는 다릅니다.
알파 나선
알파 나선은 DNA 코일과 매우 흡사 한 코일에 배열 된 아미노산 가닥이다. 수소 결합은 카르 보닐 산소로 만들어지고 아미드 그룹 4 위치 (묘사되지 않음)

베타 시트
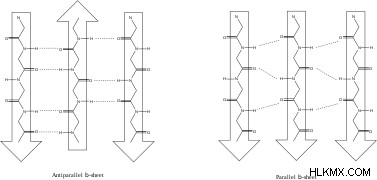
베타 시트는 서로 일치하는 아미노산 가닥으로, 큰 연결된 아미노산을 만듭니다. 베타 주름 시트의 가닥은 동일한 방향성 또는 교대 방향성을 가질 수 있으며, 각각 평행하고 반대 할렐 베타 시트를 생성 할 수 있습니다.
3 차 구조
2 차 구조에 대한 우리의 논의는 우리를 카르 보닐 및 아미노기 (모든 아미노산에 존재 함)와 수소 결합에 소개했습니다. 아미노산의 더 독특한 배열을 생성 할 때 더 많은 유형의 상호 작용이 형성됩니다. 단백질의 카르 보닐 및 아민 그룹은보다 복잡한 방식으로 서로 상호 작용할 수 있으며 R 그룹에 존재하는 각 아미노산에 고유 한 다른 화학적 특징과 상호 작용할 수 있습니다. 정전기 상호 작용 및 이황화 결합과 같은 상호 작용은 일반적으로 단백질 구조를 함께 유지합니다.
정전기 상호 작용
전하에 기초한 원자 또는 분자 사이의 정전기 상호 작용은 형성됩니다. 아미노산 측쇄 또는 R 그룹은 라이신, 아스파르트산과 같은 음전하와 같은 양전하를 가지거나 글리신처럼 중성입니다. 양으로 하전 된 아미노산은 음으로 하전 된 아미노산을 유발합니다. 보다 일반적으로 단백질의 양성 영역은 부정적인 영역을 유치합니다.
소수성 상호 작용
소수성 상호 작용은 소수성 잔기 (비극성)가 더 친수성 (극, 물과 같은) 대응 물보다 물과의 상호 작용이 적을 수있는 경향을 설명합니다. 전하가없고 비극성이 아닌 아미노산은 "뭉치"하는 경향이 있으며, 극지방은 물과 상호 작용하기 위해 더 개방적입니다.
이황화 결합
이황화 결합은 아미노산, 시스테인에서 일반적으로 발견되는 황 원자 사이의 공유 결합이다. 이황화 이황화 연계 또는 교량이라고도 불리는 이들은 단백질에서 아미노산 사이에 연결을 형성하는 또 다른 방법을 제공하고 단백질 폴딩에 기여합니다.
.4 차 구조
4 차 구조는 두 가닥의 아미노산 또는 두 개의 단백질이 서로 상호 작용하는 방법을 설명합니다. 단백질의 3 차 구조를 안정화시키는 동일한 상호 작용은 단백질이 4 차 구조에서 상호 작용하는 데 도움이됩니다.
단백질 폴딩에 영향을 미치는 것은 무엇입니까?
접힌 단백질 내에 존재하는 모든 특정 상호 작용을 통해 단백질은 특정 조건에서만 안정적이라는 것이 합리적 일 수 있습니다. 단백질은 열, pH, 염분 (존재하는 염의 양) 및 다른 분자의 존재로 인해 형태를 잃거나 변성 할 수 있습니다. 앞에서 논의한 바와 같이, 1 차 구조의 변화 또는 돌연변이는 단백질이 접힌 방식에도 영향을 줄 수 있습니다.
추가 읽기
- 단백질 및 아미노산
- 크로마토 그래피 란 무엇입니까?
- 수소 결합이란 무엇입니까?
- 이온 결합 대 공유 결합
- 극성 대 비극성 결합 및 분자