핵심 개념
이 튜토리얼에서는 명명법 및 Ionic 화합물 명명에 대해 배우게됩니다 . 우리는 이진 및 다 원소 이온 성 화합물의 화학적 공식에서 이름을 도출 할 것입니다.
다른 기사에서 다루는 주제
- 유기 화합물의 Iupac 명명
- 공유 화합물 이름 지정
- 분자 대 화합물
- 이름 지정 알칸
- 일반적인 다 원자 이온
어휘
- 화합물 : 둘 이상의 화학 요소로부터의 원자로 구성된 분자를 함유하는 물질 (이온 또는 공유)
- 이온 : 전하를 갖는 원자 또는 원자 그룹
- 충전 : 빼기 (양성자 전자)에 의해 발견; 전자 전달로 인한 이온 결합 동안의 변화
- 양이온 :양으로 하전 된 이온; 중성 원자가 전자를 잃을 때 형성됩니다
- 음이온 :양으로 하전 된 이온; 중성 원자가 전자를 잃을 때 형성됩니다
- 양이온 참가자는 거의 항상 금속입니다
- 음이온 참가자는 거의 항상 비 메탈입니다 입니다
- 의 원자가 포함됩니다.
- 는 다 원자 양이온 및 음이온
- 로 혼자서있을 수 있습니다
- 는 단일 충전 된 단위 역할을합니다
- 는 결합하여 화합물을 형성 할 수 있습니다
소개
이온 성 화합물은 무엇입니까? 이온 성 화합물은 원자 나 분자가 반대 전하로 다른 사람들을 끌어들일 때 형성됩니다. 이러한 상호 작용은 일반적으로 양전하를 전달하는 금속과 음전하를 전달하는 비금속 사이에서 발생합니다. 참가자들 사이의 정전기 인력은 그들 사이의 전자 전달을 용이하게한다.
이 화합물은 자신을 "격자"구조로 배열합니다. 이온성 격자는 각 이온이 반대로 하전 된 이온을 둘러싼 정기적 인 패턴을 형성하도록합니다. 이 화합물의 이름을 지정하려면 이온 구성 요소를 고려해야합니다.
이진 이온 성 화합물
먼저, 우리는 이진 이온 성 화합물의 이름을 짓는 방법을 배웁니다. 두 참가자는 모나토미아 일 수 있습니다. 또는 각각 다중 원자로 구성 될 수 있습니다. 어느 쪽이든, 이진 이온 명명 공정이 적용됩니다.
할라 드 또는 산소를 가진 금속의 화합물은 일반적으로 이온 고체 입니다. 양이온과 음이온을 연결하는 격자가있는 정전기력과 함께 고정되어 있습니다.
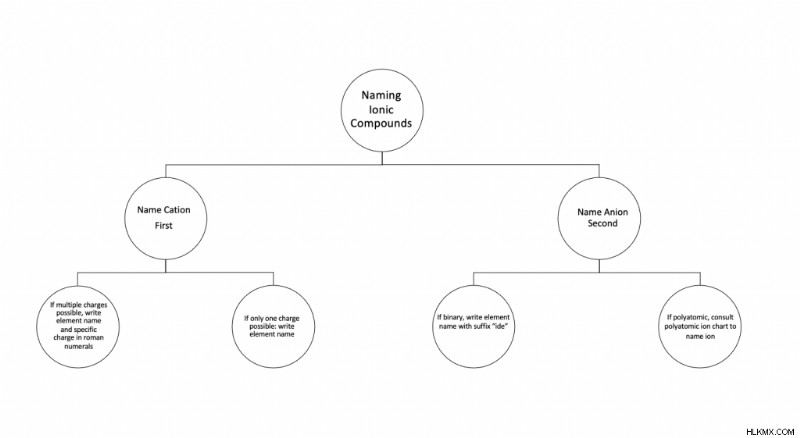
먼저 양이온 이름
양이온 또는 양으로 하전 된 입자는 항상 화합물의 이름을 시작합니다. 그러나 특정 명명 규칙은 원소 그룹마다 다릅니다.
그룹 1과 2
주기율표에서 첫 번째 및 두 번째 그룹 내에서 발견되는 요소는 항상 그룹 번호와 동일한 전하로 이온을 형성합니다. 이 꾸준한 경향은 이러한 요소 중 하나를 포함하는 화합물이 단순히 그 이름으로 시작한다는 것을 의미합니다.
예를 들어, 그룹 1의 칼륨 이온은 항상 1+의 전하를 가지고 있습니다. 따라서 그 화합물의 이름은“칼륨”으로 시작할 것입니다. 그룹 2도 마찬가지입니다. 2+ 충전이있는 마그네슘 양이온이 함유 된 화합물의 이름을 말하면“마그네슘”을 쓰는 것으로 시작합니다.
이 두 그룹의 외부의 일부 금속은 거의 항상 같은 전하를 가지고 있습니다. 알루미늄, 아연, 스칸듐 및은은 일반적으로 +3, +2, +3 및 +1의 전하를 가지므로 다른 금속과 마찬가지로 로마 숫자를 사용하지 않습니다.
음이온 두 번째 이름
양이온 이름을 작성한 후, 당신은 모나토미아 음이온의 이름과 접미사“IDE”라는 이름을 배치 할 수 있습니다. 예를 들어, 화학식 KCl은“칼슘 클로라이드”라는 이름을 생성합니다.
.명명 전이 금속 양이온
그러나 그룹 1과 2를 넘어 확장되면 상황이 조금 더 어려워집니다. 화합물은 중성 또는 0의 순 전하를 원한다는 것을 상기하십시오. 양이온의 양전하는 음이온의 음전하의 균형을 유지해야합니다.
전이 금속이라고 불리는 그룹 3-twelve의 요소는 상황에 따라 다른 수의 전자를 잃습니다. 그것들은 다른 전하로 양이온을 형성하여 다른 특성을 가진 고유 한 화합물을 생성합니다. 당신은 주어진 음이온 성분의 반대 값과 동일시하여 전이 금속 양이온의 전하를 결정하여 모든 원자를 고려합니다.
.주식 시스템
이러한 변형을 해결하려면 재고 시스템을 사용하십시오. 이 방법은 로마 숫자를 사용하여 화합물에서 양이온 전하를 나타냅니다. 숫자를 괄호 안에 놓고“Ion”이라는 단어로 따라야합니다.
.rand fe는 주요 예입니다. 철은 2+ 충전 또는 3+ 전하를 운반 할 수 있습니다. 음이온이 3 차 충전을 보유하는 경우 양이온에 대한 3+ 충전을 선택하십시오. 음이온이 2 차 충전을 보유하는 경우 양이온에 2+ 충전을 선택하십시오. 양이온을 "철 (II)"또는 "철 (III)으로 호출하여 어떤 경우인지 명확히 할 수 있습니다.
반복하기 위해, 하나의 전하만으로 이온을 형성하는 요소를 이런 식으로 작성할 필요는 없습니다. 이 방법은 전이 금속 전하 주변에서 구체적으로 모호성을 제거합니다.
이 경우 음이온을 작성하는 과정은 변경되지 않습니다. 전환 요소 양이온 및 해당 충전 후 음이온 요소의 이름을 놓습니다. 예를 들어, 화합물 Co 2 CL은“코발트 (II) 클로라이드”라는 이름으로 번역됩니다.
이진 이온 성 화합물의예 :
- NaCl :염화나트륨
- zni 2 :요오드화 아연
- al 2 o 3 :산화 알루미늄
- fecl 3 :철 (III) 클로라이드
- PBO :납 (II) 산화물
다 원자 이온 성 화합물
다 원소 화합물은 여러 유형의 원자를 함유한다.
그들은 나노 3 에 의해 예시 된 바와 같이 하나의 모노 토믹 성분과 하나의 다 원자 성분을 가질 수있다. 질산나트륨. 또는 (nh₄) ₂ SOA ₄, 황산 암모늄에서 볼 수 있듯이 두 개의 다 원자 성분을 가질 수 있습니다.
다 원소 이온 성 화합물은 처음에 복잡해 보일 수있다. 그것들은 스스로 복합이기 때문에 제목에는 기존 이름이 포함됩니다. 그러나 그들의 이름 지정 과정은 먼저 양이온을 작성하고 음이온을 작성하는 것도 포함됩니다.
예를 들어, Nano 3 "질산 나트륨"이라고합니다. 나트륨은 위의 동일한 규칙에 따라 명명됩니다. 그러나
다 원자 이온 성 화합물의 예 :
- caco 3 :탄산 칼슘
- nh₄no 3 :질산 암모늄
- kno 3 :질산 칼륨
- fe (OH)
2 :철 (II) 수산화물 - na 3 po 4 :인산 나트륨
- sn 3 (po 4 )
4 :주석 (iv) 인산염
일반적인 다 원자 양이온 및 음이온에 익숙해야하므로 이온 성 화합물을 명명하는 동안 사용할 수 있습니다. 아래 차트는 알아야 할 양이온 및 음이온의 요약을 제공합니다.
일반적인 다 원자 이온 :
| 다 원소 양이온 | 다 원자 음이온 |
| nh 4 :암모늄 | no 3 :질산염 |
| h 3 O :Hydronium | no 2 :아질산염 |
| 오 :수산화물 | |
| clo 3 :염소산염 | |
| clo 2 :염소산염 | |
| cro 4 :크로메이트 | |
| co 3 :탄산염 | |
| hco 3 :중탄산염 | |
| ch 3 COO :아세테이트 | |
| so 4 :황산염 | |
| so 3 :황산염 | |
| po 4 :인산염 | |
| po 3 :인산염 | |
| cn :시안화물 | |
| c 2 o 4 :옥살 레이트 |
 이온 성 화합물의
이온 성 화합물의