주요 차이 - 에틸렌 대 아세틸렌
에틸렌과 아세틸렌은 탄화수소입니다. 그들은 화학적 및 물리적 특성이 매우 다릅니다. 에틸렌은 자연적으로 원유 및 천연 가스에서 발견 될 수 있습니다. 또한 식물에서 과일의 숙성을 유발하는 식물 호르몬으로 발견됩니다. 아세틸렌은 알킨입니다. 선형 분자이며 가연성이 높습니다. 따라서 연료로 사용됩니다. 아세틸렌은 주로 정제소의 열 크래킹 공정에 의해 생성됩니다. 에틸렌과 아세틸렌의 주요 차이점은 에틸렌은 알켄이고 아세틸렌은 알킨입니다.
주요 영역을 다루었습니다
1. 에틸렌이란?
- 정의, 화학적 특성, 제조, 사용
2. 아세틸렌이란?
- 정의, 화학적 특성, 제조
3. 에틸렌과 아세틸렌 사이의 유사성
- 일반적인 특징
4. 에틸렌과 아세틸렌의 차이점은 무엇입니까
- 주요 차이점 비교
핵심 용어 :아세틸렌, 촉매 크래킹, 원유, 에탄, 에틸렌, 에틸, 천연 가스, 열 균열

에틸렌
에틸렌은 화학식 H 2 를 갖는 가장 간단한 알켄입니다. C =ch 2 . 이중 결합을 통해 서로 결합 된 2 개의 탄소 원자가 있습니다. 무색의 가연성 가스입니다. 에틸렌의 IUPAC 이름은 에탄 입니다 . 이 화합물의 몰 질량은 28.05 g/mol입니다. 녹는 점은 -169.2 ° C이고 끓는점은 -103.7 ° C입니다.
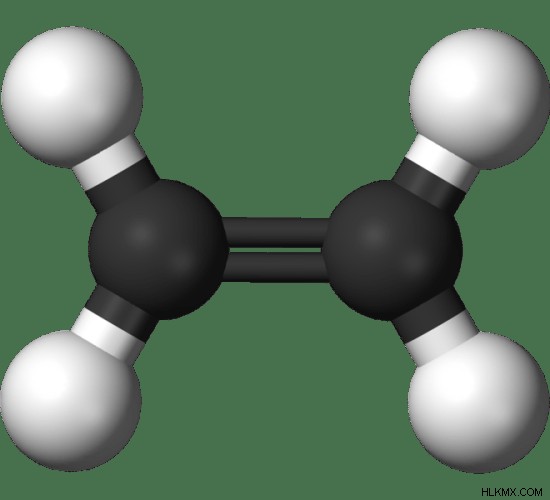
그림 1 :에틸렌의 볼 앤 스틱 모델. 검은 색 - 탄소 원자, 흰색 - 수소 원자
에틸렌은 달콤한 맛과 냄새가납니다. 에틸렌의 천연 공급원은 원유와 천연 가스입니다. 에틸렌은 중합체와 같은 중요한 화합물을 만드는 데 사용됩니다. 에틸렌 중합에 의해 수득 된 중합체는 폴리 (에틸렌), 폴리 (클로로 에덴) 및 폴리 (페닐에 텐)를 포함한다. 에틸렌에서 생산 된 다른 화학 물질에는 에탄올과 에폭시 에탄이 포함됩니다.
에틸렌에는 두 개의 탄소 원자가 SP 하이브리드 화 된 두 개의 탄소 원자가 있습니다. 탄소 원자는 시그마 결합 및 PI 결합을 통해 결합된다. 각각의 탄소 원자는 2 개의 수소 원자에 결합된다. 평면 분자입니다. 하나의 탄소 원자 주위의 형상은 삼각 평면입니다. PI 결합은 에틸렌 분자의 반응성을 담당합니다.
제조 공정
에틸렌은 균열 반응에 의해 생성됩니다. 천연 가스 및 원유의 증류로부터 얻은 분획에는 다음과 같이 3 개의 주요 균열 반응이 적용됩니다.
- 천연 가스 및 원유에서 에탄과 프로판의 증기 균열
- 원유에서 나프타의 증기 균열
- 원유에서 가스 오일의 촉매 균열
에틸렌의 사용
에틸렌의 주요 사용은 중합체 생산을위한 단량체입니다. 포장 목적으로 사용되는 폴리에틸렌은 에틸렌의 가장 널리 사용되는 제품 중 하나입니다. 에틸렌은 또한 계면 활성제 생산에 사용되는 주요 원료 인 에틸렌 옥사이드를 생산하는 데 사용됩니다. 또한 에틸렌은 식물 호르몬으로 중요합니다. 그것은 과일의 숙성, 꽃의 개방 등을 조절합니다.
아세틸렌
아세틸렌은 화학식 c 2 를 갖는 가장 간단한 알키입니다. H 2 . 트리플 결합을 통해 서로 결합 된 2 개의 탄소 원자가 포함됩니다. 탄소 원자 사이에는 두 개의 PI 결합과 하나의 시그마 결합이 있습니다. 각각의 탄소 원자는 단일 결합을 통해 수소 원자에 결합된다. 분자는 평면이고, 하나의 탄소 원자 주위의 형상은 선형입니다.
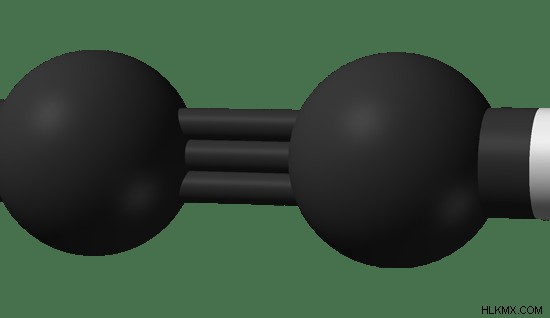
그림 2 :아세틸렌의 볼 앤 스틱 모델. 검은 색 - 탄소 원자, 흰색 - 수소 원자
아세틸렌의 몰 질량은 26.04 g/mol입니다. IUPAC 이름은 ethyne 입니다 . 무색 가연성 가스입니다. 따라서 가스로 널리 사용됩니다. 그러나 (에틸렌과 달리) 무취입니다. 아세틸렌의 용융점은 -80.8 ° C이고 끓는점은 -84 ° C입니다.
대기압에서 아세틸렌은 액체로 존재할 수 없습니다. 따라서 실제로는 용광로가 없습니다. 따라서, 아세틸렌의 트리플 포인트는 용융점으로 간주된다. 물질의 트리플 포인트는 열역학적 평형에 3 단계의 물질이 모두 존재하는 온도입니다. 트리플 포인트 아래의 온도에서, 고체 아세틸렌은 승화를 겪을 수 있으며, 여기서 고체 아세틸렌은 직접 증기 상으로 전환됩니다.
아세틸렌 제조
아세틸렌을 생산하는 가장 간단한 과정은 탄소를 물에 반응시키는 것입니다. 아세틸렌 가스와 탄산 칼슘 슬러리 (수화 석회)를 제공합니다. 산업 요구에서, 아세틸렌을 생산하는 데 두 가지 주요 방법이 사용됩니다.
- 실온에서 수행되는 화학 반응 과정
- 매우 높은 온도에서 발생하는 열 균열 공정
화학 반응 과정은 위에서 언급 한 바와 같이 탄소 칼슘으로부터 아세틸렌의 생산입니다. 열 크래킹 공정은 본드의 균열 또는 파괴 및 새로운 화합물을 얻기위한 반창기를 포함하는 방법입니다.
에틸렌과 아세틸렌 사이의 유사성
- 둘 다 탄화수소 화합물입니다.
- 둘 다 실온에서 무색 가스입니다.
- 둘 다 가연성이 높습니다.
- 둘 다 C-H 결합으로 구성되어 있습니다.
- 둘 다 불포화 화합물입니다.
- 둘 다 평면 구조입니다.
에틸렌과 아세틸렌의 차이
정의
에틸렌 : 에틸렌은 화학적 공식 H 2 를 갖는 가장 간단한 알켄이다. C =ch 2 .
아세틸렌 : 아세틸렌은 화학적 공식을 갖는 가장 간단한 알킨입니다. c 2 H 2 .
카테고리
에틸렌 : 에틸렌은 알켄입니다.
아세틸렌 : 아세틸렌은 알킨입니다.
탄소 원자 사이의 화학적 결합
에틸렌 : 에틸렌의 두 탄소 원자 사이에는 이중 결합이 있습니다.
아세틸렌 : 아세틸렌의 두 탄소 원자 사이에는 트리플 결합이 있습니다.
몰 질량
에틸렌 : 에틸렌의 몰 질량은 28.05 g/mol.
이다아세틸렌 : 아세틸렌의 몰 질량은 26.04 g/mol.
이다IUPAC 이름
에틸렌 : 에틸렌의 IUPAC 이름은 에탄입니다.
아세틸렌 : 아세틸렌의 IUPAC 이름은 Ethyne입니다.
용융점 및 끓는점
에틸렌 : 에틸렌의 용융점은 -169.2 ° C이고 끓는점은 -103.7 ° C입니다.
아세틸렌 : 아세틸렌의 용융점은 -80.8 ° C이고 끓는점은 -84 ° C입니다.
냄새
에틸렌 : 에틸렌은 달콤한 냄새가납니다.
아세틸렌 : 아세틸렌은 무취입니다.
기하학
에틸렌 : 하나의 탄소 원자 주위의 형상은 아세틸렌에서 선형입니다.
아세틸렌 : 하나의 탄소 원자 주위의 기하학은 에틸렌의 삼각 평면이다.
결론
에틸렌과 아세틸렌은 탄화수소 화합물입니다. 그것들은 각각 가장 간단한 알켄과 알키입니다. 에틸렌은 자연적으로 발견 될 수 있지만, 아세틸렌은 다른 기술적 방법을 사용하여 만들어집니다. 에틸렌과 아세틸렌의 주요 차이점은 에틸렌이 알켄이고 아세틸렌은 알킨이라는 것입니다.
참조 :
1. Lazonby, John. "Ethene (에틸렌)." 온라인으로 필수 화학 산업, 여기에서 사용할 수 있습니다.
2. Carey, Francis A.“에틸렌.” Encyclopædia Britannica, Encyclopædia Britannica, Inc., 2014 년 12 월 10 일, 여기에서 제공됩니다.
3. 제품이 어떻게 만들어지고, 여기에서 사용할 수 있습니다.
이미지 제공 :
1. Benjah-BMM27의“Ethylene-3D-Balls”-Commons Wikimedia
2를 통한 자신의 작업 (공개 도메인). Ben Mills의“Acetylene-CRC-IR-3D-Balls”-Commons Wikimedia를 통한 자체 작업 (공개 도메인)