그래서 분자는 무엇입니까 ? n이 화학 자습서, 분자 대 화합물 의 차이점을 배울 것입니다. . 그것들은 매우 비슷하지만 중요한 차이점이 있습니다! 모든 화합물에는 분자가 있지만 모든 분자는 화합물의 일부가 아닙니다.
화학 결합의 역할
원자는 반응성의 감소를 나타내는 용어 인 "균형"을 달성하기 위해 다른 원자와 화학적으로 결합합니다. 이 안정성은 이러한 본드를 제자리에 고정하는 다른 정전기 관광 명소를 통해 달성됩니다. 새로운 그룹화는 원래 부품보다 더 안정적이고 반응성이 떨어집니다.
화학 결합 동안 안정성을 보장하기 위해 원자는 "옥트 규칙"을 준수합니다. 이 가이드 라인은 원자가 외부 (원자가) 껍질에서 8 개의 전자를 달성 할 때 강력하고 꾸준한 결합이 생성된다고 명시하고 있습니다. 일부 예외가 존재하지만 규칙은 일반적으로 특정 요소의 원자가 서로 결합하는 경향이있는 이유를 설명합니다. 이 원자의 결합은 화학의 기본 개념 중 하나이며 화학 반응에 대한 우리의 이해와 관련이 있습니다.
낙지를 찾는 화학적 결합의 영역 내에 분자와 화합물의 두 가지 뚜렷한 세분이 존재한다. 모든 화합물은 분자로 분류 될 수 있지만 모든 분자를 화합물이라고 할 수있는 것은 아닙니다. 이 아이디어는 언뜻보기에 혼란스러워 보일 수 있지만, 두 범주의 차이점은 실제로 매우 간단합니다.

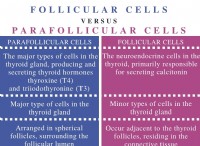
분자 대 화합물 :어느 것이 무엇입니까? 분자는 무엇입니까
분자의 정의
원자가 다른 원자와 결합 할 때 분자는 형성되고; 여기에는이 첫 번째 원자와 동일한 원소의 원자 또는 다른 원소의 원자가 포함될 수 있습니다. 분자의 또 다른 정의는 화학적 결합에 의해 함께 유지되는 2 개 이상의 원자의 전기적으로 중성 그룹이다. 분자는 화학적 및 물리적 특성을 변경하지 않고 요소 또는 화합물을 분할 할 수있는 가장 작은 입자입니다. 화학의 요소가 무엇인지 배우십시오.
화합물의 정의
반면에 화합물은 둘 이상의 다른 요소의 원자와의 원자 결합을 포함해야합니다. 따라서 항상 여러 유형의 요소를 포함합니다. 구성 부품은 고정 비율로 결합됩니다. 이 정보는 모든 화합물이 분자이지만 모든 분자가 화합물이 아니라는 초기 진술과 함께 보류됩니다. 화합물은 다른 원소의 원자를 함유함에 따라, 이들은 분자 범주의 서브 세트를 나타낸다. 그러므로 하나의 유형의 원자의 조합을 포함하는 분자는 화합물이 아니라 요소입니다.
분자 및 화합물의 예

분자와 화합물 사이의 분별력을 연습하는 데 도움이되기 위해 두 범주의 유용한 예는 다음과 같습니다. 모든 화합물이 어떻게 분자 목록에 첨가 될 수 있지만, 모든 분자가 화합물 목록으로 이동할 수있는 것은 아닙니다. 이제 분자 대 화합물을 더 잘 이해하기를 바랍니다!
분자의 예 :
이것들은 분자의 예입니다. 그들 모두는 둘 이상의 원자로 구성되지만 항상 하나 이상의 원자가는 아닙니다.
- n 2 (질소)
- i 2 (요오드)
- h 2 o (물)
- o 3 (오존)
- Cao (산화 칼슘)
- c 6 H 12 o 6 (포도당)
모든 화합물은 분자이지만 모든 분자가 화합물이 아닙니다
화합물의 예 :
다음은 화합물의 예입니다. 이 모든 화합물에는 둘 이상의 요소가 포함되어 있습니다.
- NaCl (소금)
- nahco 3 (베이킹 소다)
- h 2 o 2 (과산화수소)
- c 2 H 6 o (알코올)
- ch 4 (메탄)
- c 55 H 72 o 5 n 4 mg (엽록소)
화합물이 아닌 분자의 예
이 분자는 화합물이 아닌 원소입니다. 처음 두 가지 예는 규조토 요소입니다.
- cl 2 (염소)
- h 2 (수소)
- o 3 (오존)