이온 성 화합물은 2 개의 원자 또는 원자 그룹이 이온 결합을 공유 할 때 형성됩니다. 거의 모든 이온 성 화합물은 금속 양이온 (양으로 하전 된 부분) 및 비금속 음이온 (음의 하전 부분)을 갖는다. 양이온과 음이온 사이의 큰 전기 음성 차이는 이온 결합을 극도로 극성으로 만들고 특정 특성을 초래합니다. 다음은 이온 성 화합물의 특성 목록입니다.
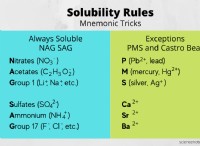
이온 성 화합물 특성 요약
이온 성 화합물은 몇 가지 유사한 특성을 공유합니다.
- 결정질 고체
- 단단하고 부서지기 쉬운 고형물
- 높은 용융 및 끓는점
- 전기를 고체로 전도하지 말고 물에 녹거나 용해 될 때
- 종종 물에 용해되고 비극성 용매에 불용성
- 공유 화합물과 비교하여 융합 및 기화의 높은 엔탈피
- 고체는 증기 압력이 낮습니다
이온 성 화합물 물리적 특성의 설명
결정질 고체
이온 성 화합물은 양이온과 음이온 사이의 인력이 매우 강하고 음이온이 양이온의 크기에 비해 크기가 작기 때문에 결정을 쉽게 형성합니다. 작은 음이온이 큰 양이온 사이의 공간으로 미끄러질 수 있습니다. 같은 전하는 서로를 격퇴하므로 결정 배열은 그것들을 분리시킵니다. 결과는 매우 안정적인 구조입니다.
단단하고 부서지기 쉬운 고형물
이온 결정의 안정성은 그것들을 단단하게 만들지 만 부서지기 쉽습니다. 망치를 사용한 스트라이크와 같은 기계적 힘은 이온 층을 이동시킵니다. 이것은 동일한 전하의 이온을 서로 가깝게 가져옵니다. 반발은 결정의 부드러운 평면을 따라 결정이 부서지게합니다.
높은 용융 및 끓는점
높은 전기성 성 차이는 양이온과 음이온을 강력하게 끌어냅니다. 액체와 가스를 형성하기 위해 분리하려면 많은 에너지 (열)가 필요합니다.
단열 고체 - 전도성 액체
이온 고체는 전기를 잘 전달하지 않습니다. 오히려, 그것들은 전기 절연체입니다. 그러나, 고체를 녹이거나 물에 용해시키는 것은 전하를 분리시킨다. 이온 성 화합물은 용융 형태의 전기 도체 또는 물에 용해 될 때 전기 도체입니다.
극성 및 비극성 용매의 용해도그들의 본질적으로, 이온 성 화합물은 극성입니다. 그들은 오일이나 헥산과 같은 비극성 용매보다 물과 같은 극성 용매에 용해됩니다.
융합 및 기화의 높은 엔탈피
융합 엔탈피는 일정한 압력에서 1 몰의 고체를 녹이는 데 필요한 열입니다. 기화의 엔탈피는 일정한 압력 하에서 하나의 액체를 기화하는 데 필요한 열입니다. 이온 성 화합물은 대부분의 공유 화합물의 것보다 10 내지 100 배 더 높은 기화 및 융합의 엔탈피를 갖는다. 엔탈피 값이 높기 때문에 이온 성분은 증기압이 낮은 경향이 있습니다. 다시 말해, 그들은 종종 냄새가 없습니다. 습한 공기에서는 일부 이온 성 화합물이 용해되어 향기를 드러 낼 수 있습니다.
친숙한 예
친숙한 예 :염화나트륨 또는 테이블 소금 (NaCl)의 행동을 고려하면 이온 성 화합물의 특성을 기억하는 것이 더 쉽습니다. 소금을 형성합니다. 자세히 보거나 돋보기를 사용하면 소금 결정의 입방 구조를 볼 수 있습니다. 열심히 소금을 뿌리지만 부수기가 쉽기 때문에 부서지기 쉽다는 것을 알 수 있습니다. 소금 더미는 전기 절연체이지만, 물에 소금을 녹이면 전기를 전도하는 강한 전해질입니다. 기름 (비극성 용매)에 소금을 첨가하면 용해되지 않습니다. 소금은 또한 녹을 때 전기를 전기하지만 800ºC의 녹는 점이 매우 높습니다. 물이나 타액에 용해 된 소금을 맛볼 수는 있지만 마른 소금을 냄새 맡으면 증기 압력이 낮기 때문에 냄새를 맡을 수 없습니다.
.참조
- Bragg, W. H.; Bragg, W. L. (1913). "결정에 의한 X- 선의 반사". 왕립 학회의 절차 :수학적, 물리 및 공학 과학 . 88 (605) :428–438. doi :10.1098/rspa.1913.0040
- Brown, Theodore L.; et al. (2009). 화학 :중앙 과학 :광범위한 관점 (제 2 판). 프랑스 숲, N.S.W. :피어슨 오스트레일리아. ISBN 978-1-4425-1147-7.
- Wold, Aaron; 드와이트, 커비 (1993). 선택된 산화물 및 황화물의 고체 화학 합성, 구조 및 특성 . Dordrecht :Springer Netherlands. ISBN 978-94-011-1476-9.
- Zumdahl, Steven S. (1989). 화학 (제 2 판). Lexington, Mass. :D.C. Heath. ISBN 978-0-669-16708-5.