달튼의 법률 핵심 개념
1801 년 영어 화학자 John Dalton 증기와 공기에 대해 관찰 한 것은 1802 년에 출판되었으며 결국 Dalton의 부분 압력 법칙 이기 때문입니다. . 이 튜토리얼에서는 부분 압력이 무엇인지, 가스의 부분 압력을 찾는 방법, Dalton의 법칙이 두더지 분율과 관련된 방법을 알게됩니다.
다른 기사에서 다루는 주제
- 압력이란?
- 찰스 법률
- Avogadro의 법칙
- 보일 법
- 이상적인 가스 법률
- van der Waal의 국가 방정식
- 게이 Lussac의 법칙
- 결합 된 가스 법률
다중 가스
1 몰의 네온 가스가 들어있는 탱크를 고려하십시오. 압력을 1- 대기권으로 두십시오. 이제 다른 두더지의 네온 가스를 추가하면 어떻게 될지 고려하십시오.
압력에 관한 기사에서 압력이란 무엇입니까 , 우리는 압력이 용기 벽에 충돌하는 가스 입자로 인해 발생한다는 것을 알고 있습니다. 가스의 두더지 양이 가스 입자의 양을 두 배로 늘리기 때문에이 두 번째 두더지 가스를 첨가하면 압력이 두 배가 될 것임을 알고 있습니다.
이제 다른 두더지의 네온 가스를 첨가하는 대신 헬륨을 추가하면 어떻게 될지 고려하십시오. 두더지의 입자의 양은 물질에 관계없이 동일하므로 우리는 우리가 추가하는 입자의 양이 이전과 동일하다는 것을 알고 있습니다.
.따라서, 우리는 다른 가스를 더 첨가함으로써 탱크의 압력이 증가 할 것이라고 결론을 내릴 수 있습니다.
부분 압력
네온과 헬륨을 함유하기 전의 탱크에서 압력은 2- 대규모가 될 것입니다. 총 두더지의 양은 2 몰이기 때문에 각 두더지는 한 대기입니다.
.이 결론에서, 우리는 각 종의 가스에 의해 가해지는 압력의 양이 전체 2 대기가 아니라 전체 압력의 일부임을 알 수 있습니다.
.Dalton의 부분 압력 법칙
Dalton의 부분 압력 법칙은이 부분의 합이 용기의 전체 압력에 추가됩니다.
이것으로부터, 우리는 방정식이 발생하는 것을 볼 수 있습니다. 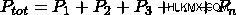 . 이 방정식은 Dalton의 법칙이며 시스템의 총 압력을 결정하는 데 사용될 수 있습니다.
. 이 방정식은 Dalton의 법칙이며 시스템의 총 압력을 결정하는 데 사용될 수 있습니다.
몰 분획 및 부분 압력
전에는 가스의 동일한 부분을 추가했습니다. 대신 불평등 한 부분을 추가하면 어떻게 될까요?
1 몰의 네온 가스 대신 제외하고 이전의 동일한 탱크를 고려하면 원래 3 몰을 추가하십시오. Avogadro의 법칙에서, 우리는 압력이 두더지의 양에 비례 할 것이라는 것을 알고 있으므로이 경우 네온 가스의 압력은 3 몰입니다.
다음으로, 우리는 1 몰의 헬륨 가스를 추가합니다. 이제 가스 몰의 총량은 두 배가되지 않고 대신 33%증가합니다. 이로 인해 컨테이너 벽과의 충돌이 33% 더 높아서 압력은 1 atm 만 증가합니다.
이것으로부터, 우리는 전체 압력이 4 atm이되고 총 두더지가 4 몰이된다는 것을 알 수 있습니다. 우리는 헬륨 가스의 두더지 부분을 복용 할 수 있습니다. 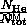 . 이것은 또한 헬륨 가스에 의해 발휘되는 압력의 일부입니다.
. 이것은 또한 헬륨 가스에 의해 발휘되는 압력의 일부입니다.
이 때문에 가스의 부분 압력은 방정식을 통해 몰 분율로 결정될 수 있습니다. 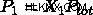
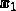 는 가스의 두더지 분율입니다.
는 가스의 두더지 분율입니다.
달튼의 법률 예제 문제
부분 압력을 찾는 방법
다음은 Dalton의 부분 압력 법칙에 대한 문제를 해결하는 방법과 가스의 부분 압력을 찾는 방법의 예입니다.
탱크에는 32g의 산소 가스와 12g의 헬륨 가스가 채워져 있습니다. 탱크의 총 압력은 4 기입니다. 산소와 헬륨 가스의 부분 압력은 무엇입니까?
먼저 산소와 헬륨 가스의 두더지 양을 결정하십시오.
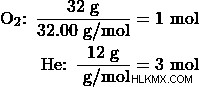
그런 다음 산소와 헬륨 가스의 두더지 분율을 결정하십시오.
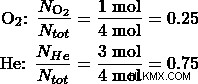
마지막으로 두더지 분율을 사용하여 부분 압력을 결정하십시오.