보일의 법률 핵심 개념
이 튜토리얼에서는 Boyle의 법칙 공식 과이 방정식을 사용하여 압력 변화와 주어진 폐쇄 시스템의 부피 변화 사이의 관계를 결정하는 방법에 대해 배웁니다.
때때로“현대 화학의 아버지”라고 불리는 Robert Boyle은 물리 및 화학 분야에서 일했습니다. 1660 년 Boyle은 공기의 봄과 무게를 출판했습니다. 그는 자신이 설계 한 진공 펌프를 사용하여 만든 다른 실험을 설명했습니다.
1662 년에 Boyle은 The Spring and Weight of the Air의 버전 2를 출판했습니다. . 이것은 현재 Boyle의 법칙으로 알려진 압력과 부피 사이의 역 관계를 설명했습니다. Boyle의 법률에 따르면 압력과 양은 서로 반비례합니다. 압력이 증가함에 따라 부피가 감소하고 압력이 감소함에 따라 부피가 증가합니다. 그는 J-Tube에서 Mercury를 사용하여 이러한 관찰을 한 다음 표준 대기압보다 낮고 높은 압력에서 가스의 부피를 측정했습니다.
.Boyle은 Boyle 's Law Requation 로 알려진 관계에서 그의 결과를 표현했습니다. 또는 Boyle 's Law Formula :P 1 v 1 =p 2 v 2 . 이 법은 온도가 일정하게 유지된다고 가정합니다.
다른 기사에서 다루는 주제
- 압력이란?
- Dalton의 부분 압력법
- 찰스 법률
- Avogadro의 법칙
- 이상적인 가스 법률
- van der Waal의 국가 방정식
- 게이 Lussac의 법칙
- 결합 된 가스 법률
- 헨리의 법칙
고려해야 할 중요한 것들
이 기사에 설명 된 가스 법률은 이상적인 가스에만 적용되며,이 기사에서 읽을 수 있습니다. 이상적인 가스 법률 .
압력과 부피의 관계
1 리터 용기에 가스 샘플을 고려하십시오. 우리의 기사에서 압력이란 무엇입니까 , 우리는 가스로부터 용기에 가해지는 압력이 입자의 충돌의 합이며, 용기의 표면적으로 나뉘어진다는 것을 알고있다.  . 우리는 또한 부피가 표면적과 관련이 있다는 것을 알고 있으며, 부피가 감소하면 표면적도 감소 할 것입니다.
. 우리는 또한 부피가 표면적과 관련이 있다는 것을 알고 있으며, 부피가 감소하면 표면적도 감소 할 것입니다.
이 두 관계에서 볼륨이 감소함에 따라 총 압력이 증가 할 것임을 알 수 있습니다. 이것은 우리를 Boyle의 법률 공식으로 이끌어줍니다. 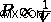 .
.
우리는 다음과 같이이 관계의 그래프를 만들 수 있습니다 :
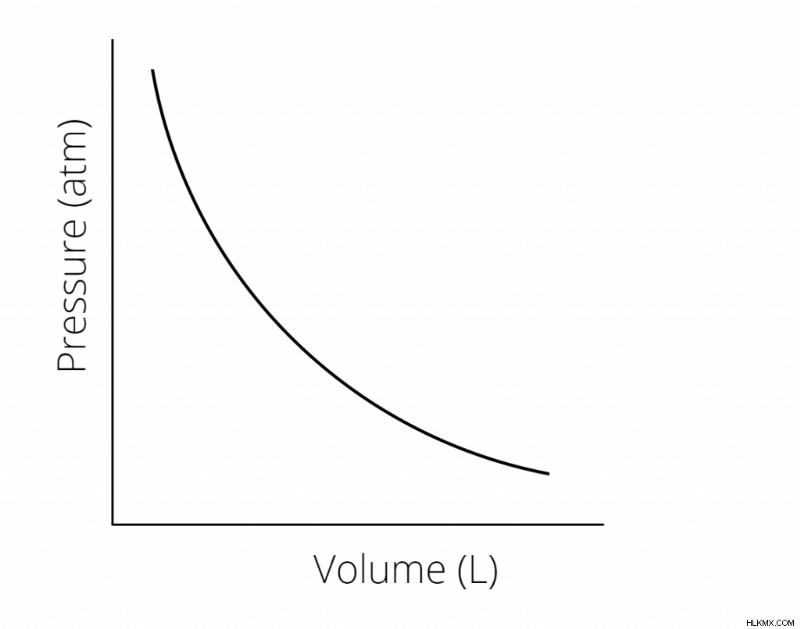
압력과 부피의 변화
이 비례 성은 폐쇄 시스템에서 압력 및 부피의 변화와 관련된 특정 문제를 해결할 수 있습니다.
예를 들어 산소로 가득 찬 피스톤을 고려하십시오. 이 비례에서, 우리는 피스톤이 압축되면 가스의 압력이 증가한다는 것을 알고 있습니다.
Boyle의 법률 방정식 - 예제 문제
다음은 Boyle의 법률 문제를 해결하는 방법의 예입니다.
이상적인 가스는 2 L 컨테이너에 3 atm의 압력 을가합니다. 컨테이너의 부피가 일정한 온도에서 1 L로 변경되면 압력은 얼마입니까?
해결책 :
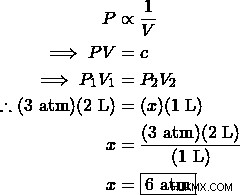
학생이 Boyle의 원래 데이터를 사용하여 Boyle의 법칙을 확인하는 방법에 대해 읽을 수 있습니다.