핵심 개념
이 튜토리얼에서는 pka 에 대해 배우게됩니다 KA 및 PH와의 관계 및 KA 및 PH에서 PKA를 계산하는 방법
다른 기사에서 다루는 주제
- 산-염기 화학
- 강산 및 염기
- 유형의 화학 반응
- 산 및 염기의 특성
어휘
Bronsted Acid - 다른 분자에 양성자 (h)를 기증 할 수있는 모든 종.
PKA는 무엇입니까?
간단히 말해서, PKA는 산이 얼마나 약하거나 강한지를 보여주는 숫자입니다. 강산은 PKA가 0보다 작습니다. 보다 정확하게 - PKA는 KA 값의 음의 로그베이스 10 (산 해리 상수)입니다. 그것은 산의 강도를 측정합니다. PKA의 값이 낮을수록 산이 강하고 양성자를 기증하는 능력이 커집니다.
PKA 및 KA
Ka는 산 해리 상수를 나타냅니다. 그것은 수용액에서 산이 얼마나 완전히 분리되는지를 측정합니다. KA의 값이 클수록 산으로 산이 이온에 크게 분리됩니다.
ka ~ pka
PKA와 KA의 관계는 다음 방정식으로 설명됩니다.
pka =-log [ka]
pka to ka
반대로, KA는 PKA가 제공 될 때 측정 할 수 있습니다.
ka =10
PKA 및 PH
pH는 수용액에서 수소 이온의 농도의 척도이다. pH 값이 낮을수록 용액에서 수소 이온 농도가 높아졌다; 따라서 산이 강할수록
PKA와 pH는 PKA가 특정 pH에서 분자가 무엇을 할 것인지 예측하는 데 도움이되므로 관련이 있습니다. 본질적으로, PKA는 화학 종이 양성자를 기증하거나 받아 들일 수 있도록 pH가 무엇인지 보여줍니다.
PKA와 PH의 관계는 Henderson-Hasselbalch 방정식에 의해 설명됩니다.
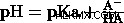
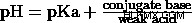
일부 약하고 강산의 PKA :
수소 세산 PKA =9.21 (HCN, 약산) :
아세트산 PKA =4.75 (약산)
Hydrofluoric acid pka =3.14 (HF, 약산)
염산 PKA =-8 (HCL, 강산) :
황산 PKA ~ 3 (강산)
더 많은 PKA가 여기 있습니다.
우리가 가장 좋아하는 화학 실험
이 비디오에서 산, 기반 또는 PKA가없고 매우 멋진 화학!







