화학 방정식이란 무엇입니까?
화학 방정식 상징과 숫자를 사용한 화학 반응을 나타냅니다. 화학적 방정식은 상이한 반응물 및 제품의 상대적 몰량 및 동일성을 보여준다. 균형 화학 방정식은 반응에 관련된 화합물의 정확한 비율을 결정하는 데 도움이 될 수 있습니다!
화학 방정식의 기초
1. 화학 방정식의 기본 부분
화학 방정식에는 3 가지 기본 부품이 있습니다 :반응물, 제품 및 "수율"화살표
| | 반응물 | 수율 | 제품 |
| 정의 | 반응물은 반응에 필요하고 반응 동안 화학적 변화를 겪는 화합물 또는 요소입니다. | . 반응에서“수율”은“생산”또는“형태”를 의미하며 일반적으로 화살표로 표시됩니다. 반응물이 화학적 변화를 겪으면 수율 제품. | 제품은 화학 반응에서 최종 결과 또는 생산 된 화합물입니다. | .
| 예 | ch 4 (g) + 2o 2 (g) | → | co 2 (g) + 2h 2 o (g) |
반응물 및 생성물은 여러 분자가 함께 추가되며, 이는 화학 방정식의 경우입니다. 그러나 수익은 화살표가 몇 가지 다른 스타일로 올 수 있습니다.
- 전방 화살표 (→)는 일반적인 반응을 보여줍니다.
- 평형 화살표 (⇌)는 가역적 과정을 보여줍니다.
- 공명 화살표 (↔)는 둘 이상의 종이 서로의 공명 구조임을 보여줍니다.
- 이론적 화살표 (⇢)는 이론적 과정을 보여줍니다.
- Retrosynthetic Arrow (⇒)는 반응물에서 제품으로 얻을 수있는 잠재적 인 방법을 보여줍니다.
2. 화학 방정식의 숫자
화학 방정식에는 두 가지 유형의 숫자가 있습니다 :첨자 및 계수. 구독 분자에 각 원소의 얼마나 많은 원자가 존재하는지를 나타냅니다. 계수 반응에 특정 화합물의 얼마나 많은 분자가 존재하는지를 나타냅니다. 균형 방정식에서 분자 계수 만 변경할 수 있습니다.
첨자 인 분자 동일한 원소의 원자는 다릅니다 (예 :h 2 o vs. h 2 o 2 )는 다른 화학적 조성물을 가지고 있으며, 이는 그것들이 같은 화합물이 아님을 의미합니다. 이러한 이유로 화학 방정식의 균형을 맞추면 분자 위시를 변경할 수 없습니다. 다른 계수를 갖는 동일한 분자 (예 :2h 2 O 및 5H 2 o) 다른 양으로 존재하는 동일한 화합물입니다.
분자에서 3NO 2 , 계수는 3입니다 (no 2 의 3 개의 분자가 있습니다. ) 및 산소의 첨자는 2입니다 (NO 2 의 1 분자에 2 개의 산소 원자가 있습니다. ). 전체적으로 6 개의 산소 원자가 있습니다 (No 2 의 3 분자. 및 No 2 의 1 분자 당 2 개의 산소 원자 .)
계수 각각의 분자 또는 화합물은 상대를 나타낸다 돌 또는 분자의 수에서 반응에서 원소의 양. 그것들은 상대적인 수량이기 때문에 숫자는 비율로 해석 될 수 있습니다. 위의 예에서, 비율은 1 ch 4 입니다. :2o 2 :1 Co 2 :2h 2 O. 비율이 일정하는 한, 비례 계수 (예 :2 :4 :2 :4, 3 :3 :3 :6 등)로 방정식을 올바르게 다시 작성할 수 있지만 가장 작은 정수 계수를 사용하는 것이 일반적입니다 .
3. 질량 보존 법칙
물질 (또는 원자)이 화학 반응에서 생성되거나 파괴되지 않는 질량 상태의 보존 법칙. 이것은 화학 반응이 발생하기 전후에 각 화합물의 양이 있어야 함을 의미합니다. 법은 방정식의 양쪽에 각 화합물의 상대적인 양이 있어야하기 때문에 화학 방정식의 균형을 맞추는 데 적용됩니다.
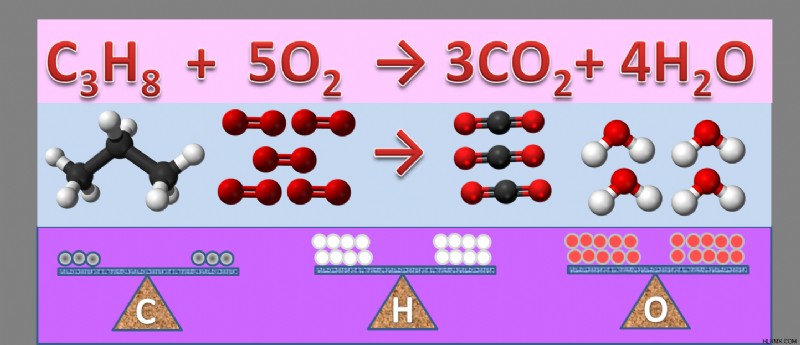
다음은 메탄이 공기 중에 화상을 입어 이산화탄소와 수증기를 생산하는 반응의 예입니다.
ch 4 (g) + 2o 2 (g) → Co 2 (g) + 2h 2 o (g)
보시다시피, 방정식의 양쪽에는 각각 1 개의 탄소 원자, 4 개의 수소 원자 및 4 개의 산소 원자가 있습니다. 따라서 방정식은 균형을 이룹니다.
화학 방정식 작성 및 균형을 맞추기위한 단계
- 반응물 및 제품의 이름을 식별하십시오. 단어 방정식 을 작성하는 것이 도움이 될 수 있습니다. 반응에 모든 화합물을 나열합니다. 단어 방정식에서 반응물과 제품은 이름으로 표시되며, 이는 분자 공식 대신 단어 형식으로 작성됩니다.
- 단어 방정식은 수량이 아닌 화합물의 이름 만 보여줍니다. 이것은 단어 방정식이 반응의 전체 그림을 보여주지 않음을 의미합니다.
- 단어 방정식을 사용하여 공식 방정식 을 작성하십시오 모든 화합물을 화학적 공식으로 다시 작성함으로써.
- 공식 방정식은 균형이 맞지 않습니다 . 그들은 화합물 만 화학적 공식으로 보여줍니다.
- 화학 방정식을 작성하기 위해 질량 보존 법칙을 사용하여 공식 방정식의 균형을 유지하십시오.
- 방정식의 양쪽에 한 번만 나타나는 요소의 원자를 세고 먼저 균형을 맞추십시오. 방정식의 양쪽에 여러 번 나타나는 균형 균형
- 일반적으로 수소 또는 산소 원자가 마지막으로 균형을 유지하십시오.
- 모든 원자 균형을 유지 한 후에는 균형 잡힌 공식 방정식 또는 화학 방정식 가 있습니다. .
화학 방정식 균형 - 예
반응의 균형 :공기 중에 메탄 화상과 산소와 결합하여 이산화탄소 및 수증기를 생산합니다
1. 방정식이라는 단어를 쓰십시오
반응을 단어 방정식으로 작성하십시오 :메탄 + 산소 → 이산화탄소 + 물
2. 방정식을 공식 방정식
로 다시 작성하십시오
공식 방정식으로 다시 작성하십시오 :ch 4 (g) + o 2 (g) → Co 2 (g) + h 2 o (g)
3. 질량 보존 법칙을 사용하여 공식 방정식의 균형.
- 방정식에 한 번 나타나는 요소의 원자를 계산하십시오. 이 예에서는 탄소와 수소 원자가 한 번 나타나고 산소는 오른쪽에 두 번 나타납니다.
- 균형 수소와 산소 원자가 마지막으로. 산소가 두 번 나타나므로 산소 균형을 유지합니다. 이 예에서는 탄소의 균형을 유지 한 다음 수소 및 산소를 마지막으로 시작합니다.
. - 방정식의 왼쪽에 하나의 탄소 원자가 있습니다 (ch 4 ), 하나는 오른쪽에 있습니다 (Co 2 ). 따라서 탄소는 이미 균형을 이룹니다. 탄소를 함유하는 두 화합물 (CH <서브> 4 및 Co 2 )는 1의 계수가 있어야합니다. 동일한 수의 탄소 원자를 갖기 위해서는 동일하게 존재해야하기 때문입니다.
- 방정식의 왼쪽에 4 개의 수소 원자가 있습니다 (ch 4 ), 오른쪽에 2 (h 2 영형). 수소 원자의 균형을 잡으려면 오른쪽에 2 개의 더 많은 수소 원자가 필요합니다. H 2 의 계수를 곱합니다 o 2는 2h 2 를 제공합니다 O, 4 개의 수소 원자가 있습니다.
- h 2 를 변경하려고 시도하지 않는 것이 중요합니다 o h 4 o 수소 원자의 균형을 잡기 위해. 그렇게하면 화학적 동일성이 바뀌고 H 4 O는 물이 아닙니다. 전체 화합물을 곱합니다 (h 2 o) 화학적 동일성을 변경하지 않고 반응의 물 분자의 수를 변경합니다.
- 공식 방정식은 이제 :1ch 4 입니다 (g) + 1o 2 (g) → 1co 2 (g) + 2h 2 o (g)
- 이제 왼쪽에 2 개의 산소 원자가 있습니다 (O 2 ) 및 오른쪽에 4 (2H 2 O 및 Co 2 ). o 2 의 계수를 곱합니다 2 x 2는 2o 2 를 제공합니다 4 개의 산소 원자가 있습니다.
- 모든 원자가 균형을 이루면 화학 방정식이 있습니다. ch 4 (g) + 2o 2 (g) → Co 2 (g) + 2h 2 o (g)
4. 모든 원자를 계산하여 균형 방정식을 확인하십시오.
| 왼쪽 | 오른쪽 |
| Carbon Atoms-1 (ch 4 ) | Carbon Atoms-1 (co 2 ) |
| 수소 원자-4 (ch 4 ) | 수소 원자-4 (2h 2 o) |
| 산소 원자-4 (2o 2 ) | 산소 원자-4 (2에서 Co 2 , 2에서 2h 2 o) |
추가 읽기
- 순 이온 방정식을 쓰는 방법
- 균형 산화 환원 반응
- 유형의 화학 반응
- 반응 제한