핵심 개념
이 튜토리얼에서는 수율 을 배울 수 있습니다 그리고 그것을 계산하는 방법. 또한 예제 계산을 살펴 봅니다.
다른 기사에서 다루는 주제
- 어금니 질량 계산
- 주기적인 테이블을 읽는 방법
- 분자 대 경험적 공식
- 화학 반응이 쉬워졌습니다
수율 백분율은 얼마입니까?
실험을 수행 할 때 완벽한 반응 조건이있는 경우 얻을 수있는 최대 수율이 있습니다. 이것은 이론적 수율 입니다 . 그러나 실험을 올바르게 따르더라도 제품의 완벽한 수율이 없을 가능성이 높습니다. 당신이 가진 제품의 양은 당신의 실제 수율 입니다. .
실험에서 얻은 이론적 수확량의 비율은 percent 수율 입니다. . 아래에서 계산하는 방법을 배우겠습니다!
수율 백분율을 계산하는 방법
아래 방정식을 사용하여 실험에서 수율을 계산할 수 있습니다.
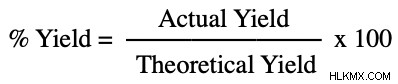
이론적 수율 계산
먼저, 실험의 이론적 수율을 계산해야합니다. 일반적으로 여기에는 화학량 론적 계산이 포함됩니다. 주어진 화학 방정식과 정보를 먼저 살펴보면 무엇이 반응하는지, 제품이 어떻게 형성되는지에 대한 아이디어를 얻을 수 있습니다.
제한 시약이 다 떨어지면 더 이상 제품을 형성 할 수 없으므로 다음 단계는 제한 시약을 식별하는 것입니다.
그런 다음 치수 분석을 사용하여 주어진 제한 시약의 양에 따라 얼마나 많은 제품을 형성 할 수 있는지 확인할 수 있습니다. 이것은 실험의 이론적 수율입니다.
실제 수율 계산
당신이 육체적으로 실험을하는 경우, 실제 수확량은 균형에 무게를 측정하는 제품의 양입니다. 단어 문제를 수행하는 경우 문제 내에서 실제 수율이 주어질 수 있습니다.
% 수율 방정식
마지막 단계는 일단 이론적 수율과 실제 수율을 모두 갖는다면 숫자를 방정식에 연결하는 것입니다. 실제를 이론적으로 나누면 당신이 만든 제품의 일부가됩니다. 곱하면 100을 곱하면 수율이 백분율을 제공합니다.
수율 계산 예
이제 수율 백분율을 계산하는 단계를 알았으므로 예를 살펴 보겠습니다.
아래의 균형 화학 반응을 사용하십시오. 40.00 g의 아세틸렌 (c 2 인 경우 H 2 ) 및 65.00 g의 산소가 사용되며 25.00 g의 물이 생성되며, 수율은 얼마입니까?
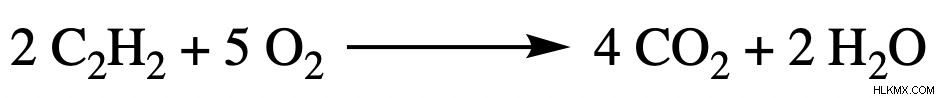
첫 번째 단계는 제한 시약 및 이론적 수율을 찾는 것입니다 :

두 시약 모두에서 치수 분석을 사용하여 아세틸렌은 산소보다 적은 양의 생성물을 생산하는 것으로 밝혀졌습니다. 이 아세틸렌은 우리의 제한 시약입니다.
27.67G는 이론적 수확량입니다. 마지막 단계는 수율 방정식 백분율에 숫자를 연결하는 것입니다.
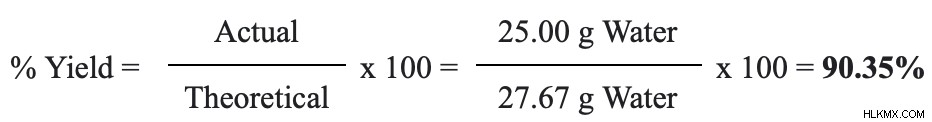
우리의 백분율 수율은 90.35%입니다.
더 많은 예제 질문을 보려면 여기를 클릭하십시오!
추가 읽기
- 일반적인 다 원자 이온
- 운동 분자 이론
- e1 반응
- e2 반응