핵심 개념
이 튜토리얼에서는 본드 에너지, 본드 엔탈피 및 채권 순서 및 엔탈피와의 관계에 대해 배우게됩니다. 또한 발열 및 흡열 반응과 함께 결합의 형성 및 파괴에 대해 배울 것입니다.
다른 기사에서 다루는 주제
- 엔탈피 계산
- 채권 주문 및 채권 강도
- 극산 결합
- 반응, 형성 및 연소의 엔탈피
어휘
엔탈피 - 화학 시스템의 열 측정; 일정한 압력 조건 하에서 측정 됨
채권 에너지 - 결합 강도의 척도; 분자를 깨는 데 필요한 엔탈피 또는 에너지를 측정하여 결정
본드 엔탈피 - 결합 에너지 또는 본드 해리 에너지와 동일합니다
발열 반응 - 열 (에너지)을 주변 환경으로 방출하는 화학 반응
흡열 반응 - 주변에서 열 (에너지)을 흡수하는 화학 반응
본드 에너지 소개
그렇다면 본드 에너지와 본드 엔탈피는 무엇입니까? 결합 에너지 (e)는 화학 결합의 강도를 측정합니다. 본질적으로, 분자를 원자로 분해하는 데 필요한 에너지의 양입니다. 결합 에너지에 대한 또 다른 용어는 결합 엔탈피 또는 본드 해리 에너지입니다. 화학 반응이 발생하면 분자 결합이 파손되고 새로운 결합이 형성되어 다른 분자를 만들어냅니다. 채권을 파괴하려면 에너지가 필요하고 채권을 형성하려면 에너지가 방출됩니다.
채권 순서 및 채권 에너지
결합 순서는 분자의 원자 사이에 존재하는 화학적 결합의 수입니다. 원자 쌍 사이에 결합이 많을수록 결합 길이가 짧을수록 결합이 강해집니다. 따라서 삼중 채권은 이중 결합보다 짧고 이중 결합은 단일 결합보다 짧습니다. 따라서 삼중 채권은 이중 채권보다 강하고 이중 채권은 단일 결합보다 강합니다.
결과적으로, 결합 에너지가 높을수록 원자 쌍 사이의 결합이 더 강하고 결합 길이가 짧아집니다. 여기에서 멋진 결합 에너지 테이블을 찾을 수 있습니다.
결합 에너지는 기체 상태에서 두 원자 사이에 특정 유형의 1 몰의 결합을 파괴하는 데 필요한 에너지의 양입니다. 고체 결정질 화합물을 기체 이온으로 분리하는 것에 대해 이야기하고 있다면 격자 에너지를보고 싶을 것입니다.
본드 형성 및 파괴
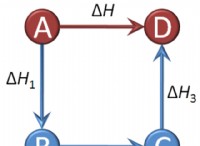
화학 반응이 발생하면 반응물의 원자는 재배치하여 생성물을 형성합니다. 새로 배열 된 결합은 반응물의 결합과 동일한 에너지를 가지지 않습니다. 따라서 화학 반응이 발생하면 항상 에너지 변화가있을 것입니다. 이러한 에너지의 변화는 반응의 엔탈피라고합니다.
엔탈피
envalpy 의 정의 (h)는 열역학적 시스템에서 총 열 에너지의 척도입니다. 엔탈피 (ΔH)의 변화가 양성 일 때, 반응은 흡열이다; ΔH가 음성 일 때, 반응은 발열이다.
일반적으로 엔탈피의 긍정적 인 변화는 결합을 깨기 위해 필요하며 엔탈피의 부정적인 변화는 결합을 형성합니다. 따라서 결합의 형성은 흡열 과정이며 결합의 분해는 발열 과정입니다.