핵심 개념
그래서 Hess의 법칙은 무엇입니까? 이 튜토리얼에서는 Hess 's Law 에 소개됩니다. ,이 개념과 함께하는 방정식뿐만 아니라. 또한 몇 가지 예제 문제를 해결 하여이 개념을 더 마스터 할 것입니다.
다른 기사에서 다루는 주제
- 화학 반응이란 무엇입니까
- 방정식의 균형을 맞추는 방법
- 깁스 자유 에너지
- 비열
- 순 이온 방정식
- 열 화학 소개
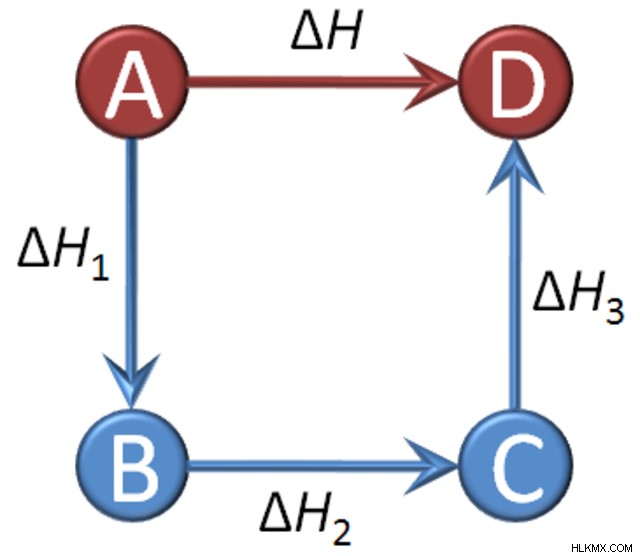
Hess의 법칙은 무엇입니까?
러시아 화학자이자 물리학 자 제르맹 헤스 (Germain Hess)는 열 화학 및 물리 화학의 개념을 개발했습니다. 그는 Hess의 끊임없는 끊임없는 배열의 법칙 또는 Hess의 법칙으로 알려진 개념을 소개했습니다.
이 법은 반응에서 순 엔진과 관련이 있습니다. 전반적으로, 반응의 총 엔탈피 변화는 반응의 단계 또는 단계의 수에 관계없이 모든 변화의 합계라고 명시하고있다 (즉, 순 엔트탈과 반응의 단계 수는 서로 독립적 임). 이 법의 아이디어는 에너지 보존 원칙 또는 열역학의 첫 번째 법칙과 같은 과학 전반에 걸쳐 있으며, 엔탈피가 상태 기능이라는 진술.
Hess의 법칙을 사용하기 위해 반응이 따라야하는 몇 가지 요구 사항이 있습니다. 예를 들어, 반응에 대한 여러 단계가있는 경우 각 방정식의 균형이 올바르게 균형을 이루어야합니다. 또한 반응 조건을 일정하게 유지하기 위해 반응의 모든 단계는 일정한 온도와 압력에서 시작하고 끝나야합니다.
Hess 's Law Requation
이 정의를 수학적 용어로 넣으려면 여기에 Hess의 법률 방정식이 있습니다.
∆H net =∑∆H r
NET 엔탈피 변경 =∆H NET
모든 엔탈피 변경 단계 =∆H <서브> r 의 합
엔탈피 변화
엔탈피 변화, ∆H는 반응 중에 흡수되거나 방출되는 열의 양으로 정의 될 수있다. 다단계 반응의 각 개별 단계에서, 시작 및 끝 엔탈피 가치가 있습니다. 이들 사이의 차이는 엔탈피 변화입니다. 이 값은 열이 흡수되면 음수 일 수 있거나 열이 방출되는 경우 양수 일 수 있습니다. 각 반응 단계의 모든 엔탈피 변화를 추가하면 (∆H r ), 당신은 그물 엔탈피 변화가 있습니다. 최종 제품 엔탈피와 초기 반응물 엔탈피 (∆H net 의 차이를 찾음으로써 발견됩니다. ). 그것은 Hess의 법칙입니다!
Hess의 법칙 예제 문제
이제 우리는 Hess의 법칙의 개념과 방정식을 이해 했으므로 실습 문제에 대한 지식을 확장합시다. 이러한 단어 문제는 반응의 일부 조작 (즉, 방향 방향, 곱셈, 분할)을 요구할 수 있지만 일반적인 아이디어는 모든 Hess의 법칙 문제에 대해 동일합니다. 아래 몇 가지 예를 살펴 보겠습니다!
예제 문제 1
NET 엔탈피 변화를 찾으십시오 (∆H net 반응 단계와 그 ∆H 값을 감안할 때 아래의 반응의)
전반적인 반응 :n 2 H 4 (l) +h 2 (g) → 2NH3 (g)
(i) n 2 H 4 (l) + ch 4 o (l) → ch 2 o (g) + n 2 (g) + 3H 2 (g) ∆H =- 37kj/mol
(ii) n 2 (g) + 3H 2 (g) → 2nh 3 (g) ∆H =-46kj/mol
(iii) ch 4 o (l) → ch 2 o (g) + h 2 (g) ∆H =-65kj/mol
1. 단계가 (a) 균형을 유지하고 (b) 올바른 방향으로 (c) 전반적인 반응을 초래하십시오.
.전체 반응에 주어진 모든 단계가 필요한지 확인하려면 방정식을 추가하고 반복 된 화합물을 교차하여 전체 방정식을 만듭니다.
그러나, 우리가 반응을 그대로 사용하면이 단계를 수행한다면, 우리는 추가 화합물뿐만 아니라 잘못된쪽에 화합물이 있기 때문에 올바른 반응으로 끝나지 않습니다. 이로 인해 단계 중 하나 또는 둘 이상의 단계가 반대 방향으로 이동하는지 분석 할 수 있습니다.
반응 (i)은 전체 방정식의 반응물 인 N2H4 (L)를 가진 유일한 반응이기 때문에, 그것이 올바른 방향으로 가고 있다고 가정합니다. 다음으로, 반응 (II)은 생성물 2NH <서브> 3 (g) 를 갖는다 오른쪽에는 방정식도 동일하게 유지됩니다. 전체 방정식을 찾으려는 위의 시도에서, 식 (i) 및 (ii)로부터의 수소 가스는 서로를 취소한다. 이로 인해 방정식 반응물과 제품을 뒤로 뒤로 방향으로 이동할 수 있습니다. 그러나 반응이 반대 방향으로 진행되기 때문에 엔탈피도“반대”가됩니다. 반응의 방향을 바꾸면 엔탈피의 상호가 새로운 엔탈피가됩니다.
"새로운"방정식 단계는 다음과 같습니다.
(i) n 2 H 4 (l) + ch 4 o (l) → ch 2 o (g) + n 2 (g) + 3H 2 (g) ∆H =- 37kj/mol
(ii) n 2 (g) + 3H 2 (g) → 2nh 3 (g) ∆H =-46kj/mol
(iii) ch 2 o (g) + h 2 (g) → ch 4 o (l) ∆H =+65kj/mol
반응 (iii)으로 모든 방정식을 추가하는 방법을 전환했습니다. 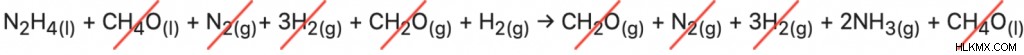
n 2 H 4 (l) +h 2 (g) → 2NH3 (g)
2. 순 엔진 변화를 찾으십시오.
이제 공식 엔탈피 값을 갖기 때문에 Hess의 법률 방정식을 사용하여 해결할 수 있습니다.
∆H
예제 문제 2
NET 엔탈피 변화를 찾으십시오 (∆H net 반응 단계와 그 ∆H 값을 감안할 때 아래의 반응의)
전반적인 반응 :CS 2 (l) + 3o 2 (g) → Co 2 (g) + 2SO 2 (g)
(i) c (s) + o 2 (g) → Co 2 (g) ∆H =-395 kJ/mol
(ii) s (s) + o 2 (g) → so 2 (g) ∆H =-295 kJ/mol
(iii) c (s) + 2s (s) → CS 2 (l) ∆H =+90 kJ/mol
1. 단계가 (a) 균형을 유지하고 (b) 올바른 방향으로 (c) 전반적인 반응을 초래하십시오.
.먼저, 위와 동일한 방법을 사용하여 모든 단계 반응이 올바른 방향으로 올바른지 확인하기 위해 올바른 방향으로 진행되는지 확인합니다. 반응 (i)은 원하는 Co 2 (g) 를 갖는다 제품은 변경되지 않은 상태로 유지 될 수 있음을 의미합니다. 반응 (III)은 CS <서브> 2 (l) 를 갖는다 생성물로서, 그러나 전체 반응에서 바람직한 반응물이다; 따라서 우리는이 반응을 뒤집고 상호 ∆H 값을 사용합니다.
반응 (ii)에 관해서는, O 2 (g) 때문에 방향이 정확하다. 반응물 및 So 2 (g) 로서 생성물은 둘 다 원하는 반응에서 볼 수있다. 그러나 방정식을 함께 추가 할 때 하나의 o 2 (g) 그리고 하나는 2 (g) 입니다 누락되었습니다 (추가 s (s) 도 있습니다 취소해야합니다). 이것은 반응 (ii)에 곱하기로 고정 될 수 있습니다 (ii). 이것을 곱하거나 나누면 동일한 계수로 ∆H 값을 곱하거나 나누어야합니다. .
(i) c (s) + o 2 (g) → Co 2 (g) ∆H =-395 kJ/mol
(ii) 2s (s) + 2o 2 (g) → 2SO 2 (g) ∆H =-590 kJ/mol
(iii) CS 2 (l) → c (s) + 2s (s) ∆H =-90 kJ/mol
반응 (ii) 및 (iii) 조작 된 상태에서 모든 방정식을 추가하는 방법은 올바른 전체 반응을 초래합니다.
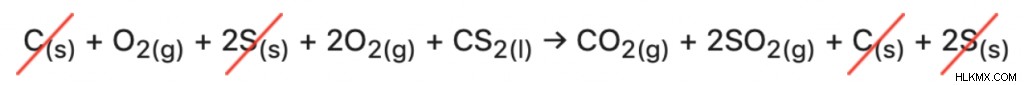
CS 2 (l) + 3o 2 (g) → Co 2 (g) + 2SO 2 (g)
2. 순 엔진 변화를 찾으십시오.
이제 공식 엔탈피 값을 갖기 때문에 Hess의 법률 방정식을 사용하여 해결할 수 있습니다.
∆H
추가 읽기
- 뉴먼 프로젝션
- 중량 % 계산
- 수율 계산
- 퇴근 그룹