핵심 개념
격자 에너지 에 대한이 튜토리얼에서 , 우리는 그 정의, 관련주기적인 테이블 트렌드, 영향을 미치는 요인 및 그것을 계산하는 방법을 다룰 것입니다.
격자 에너지 란 무엇입니까?
고체 이온 성 화합물의 형성 동안, 전기 양성 금속은 전기 음성 비금속과 반응한다. 이러한 화합물의 생성 및 용해는 KJ/mol 단위로 표현 된 잠재적 에너지의 유형 인 격자 에너지의 개념을 포함한다. 격자 에너지는 이온 성 화합물 내에서 양이온 및 음이온의 고정 위치를 유지합니다. 우리는 우리의 관점에 따라이 용어를 두 가지 다른 방식으로 더 조사 할 수 있습니다.
이 개념을 이해하는 열쇠는 이온 성 화합물의 결정 구조에 있습니다. 그들의 강력하고 단단한 조성은 각 하전 된 이온과 반대로 하전 된 상대방 사이의 상호 작용을 가능하게한다. 이러한 상호 작용은 많은 양의 에너지를 포함하여 이온 성 화합물의 높은 용융 및 비등점 특성을 설명합니다.
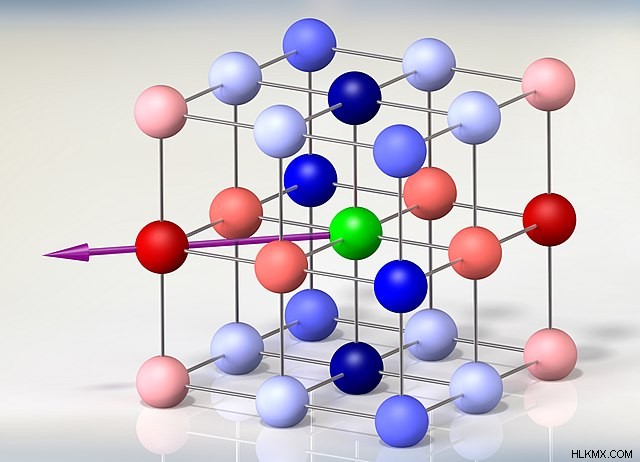
격자 에너지는 하나의 고체 이온 성 화합물의 형성 동안 가스 이온이 반응 할 때 특정 양의 에너지가 방출 될 때 설명 될 수 있고; 그러나, 그것은 또한 하나의 몰의 고체 이온 성 화합물의 구성 기상 이온에 분리를 용이하게하는 에너지를 설명한다. 우리가 선택한 정의에 따라, 주어진 이온 성 화합물의 격자 에너지는 양수 또는 음수 값 일 수 있습니다.
발열 대 흡열
우리는 격자 에너지를 우리가 집중하는 정의에 따라 흡열 또는 발열 과정으로 볼 수 있습니다. 과정은 에너지를 방출 할 때 발열됩니다. 우리의 첫 번째 정의 인 이온 성 화합물의 형성은 음의 값에 해당하는 발열 격자 에너지를 포함합니다.
반면에, 우리가 대체 정의, 이온 화합물의 용해, 격자 에너지 값의 특성을 사용하는 경우. 이 과정은 에너지가 필요하기 때문에 양수 값에 해당하는 흡열 범주에 속합니다.
요소 t 모자에 격자 에너지 에 영향을 미칩니다
1. 구성 이온이 보유한 전하 (변수 Q 1 로 표시됩니다. 및 Q 2 )
이온 전하 변수를 증가 시키면 격자 에너지가 증가합니다. 이것은 전하 값이 더 큰 이온이 더 큰 격자 에너지를 갖는 이온 성 화합물을 생성 할 것임을 의미합니다. 차례로, 약한 전하가있는 이온은 화합물의 격자 에너지를 감소시킵니다.
2. 구성 이온 사이의 거리는 (변수 R로 표시)
거리 변수를 증가 시키면 격자 에너지가 감소합니다. 본질적으로, 더 큰 이온은 이들 사이의 거리가 증가함에 따라 더 작은 격자 에너지로 이온 성 화합물을 구성한다. 작은 이온은 이온 성 화합물에서 더 큰 격자 에너지를 생성합니다.
격자 에너지 트렌드
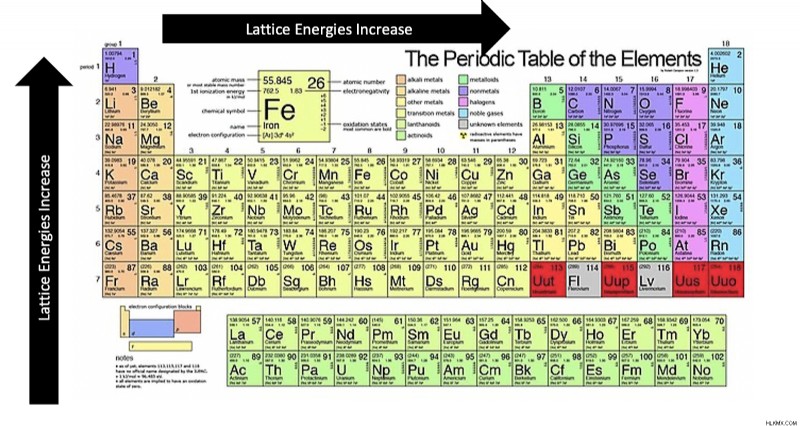
요약하면, 이온 전하를 증가시키고 거리를 줄이면서 격자 에너지가 증가합니다. 보다 구체적으로, 그것은 기간에 걸쳐 왼쪽에서 오른쪽으로, 아래쪽에서 상단으로 증가합니다.
.다음 이미지에서 격자 에너지 주기적 테이블 트렌드를 요약 할 수 있습니다.
격자 에너지 찾기
다수의 이온 성 화합물이 제시 될 때, 화학자는 종종 가장 높은 격자 에너지를 나타내는 것을 결정해야한다. 그렇게하려면 이온 전하 변수와 거리 변수를 모두 고려합니다.
격자 에너지 계산
정확한 격자 에너지를 계산하면 복잡 할 수 있지만, 우리는 종종 Coulomb의 법칙을 사용하여 프로세스를 단순화합니다. 이 법은 주어진 이온 성 화합물의 격자 에너지를 설명하는 다음 방정식을 제공합니다. 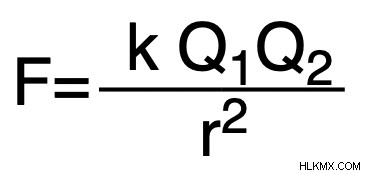
Q 1 &q 2 =이온 성 화합물에서 구성 이온의 상대 전하
r =요금 사이의 거리
k =2.31 x 10^ J-nm.
최종 답변은 Joules (J) 단위로 작성해야합니다.
해결하기위한 단계 :
- 각 이온 성 화합물에 대한 방정식을 해결하여 전하 및 거리 값을 입력합니다.
- 결과를 비교하십시오. 가장 큰 양은 가장 큰 격자 에너지를 가진 이온 성 화합물을 나타냅니다.
근사 격자 에너지
비교하는 동안, 우리는 또한 충전 및 거리 변수를 사용하여 상대 격자 에너지를 추정 할 수 있습니다.
해결하기위한 단계 :
1. 먼저 주어진 화합물에서 각 이온에 의해 표시되는 상대적 하전을 먼저 살펴 봅니다. 하나의 화합물이 훨씬 높은 이온 전하를 갖는 경우 격자 에너지가 더 높을 것입니다.
.2. 화합물 사이의 전하 불일치가 명확하지 않은 경우 q 1 를 계산하십시오. X Q 2 각 화합물에 대해 해당 값을 비교하십시오. 예를 들어, 계산 된 -3의 계산 하전은 계산 된 전하의 크기의 3 배를 -1; 이것은 -3의 전하를 갖는 이온 성 화합물이 -1 전하 (대략 3 배 높은)를 가진 이온 성 화합물보다 훨씬 높은 격자 에너지를 나타낸다는 것을 나타냅니다.
.3. 여러 화합물의 전하가 구별을 생성하기에는 값이 동일하거나 너무 유사한 경우 이온의 크기를 고려하십시오. 양이온을 양이온과 음이온과 화합물 사이의 음이온과 비교하여 원자 크기를 병치합니다. 양이온 사이 또는 음이온 사이의 크기가 상당한 불일치가 보이면, 더 큰 원자 반경을 가진 성분은 각 화합물의 격자 에너지를 낮추게됩니다. 반대로, 원자 반경이 작은 이온은 각각의 화합물의 에너지 값을 증가시킬 것입니다.
격자 에너지의 응용
Born-Haber 사이클
격자 에너지는 Born-Haber주기에 연루되어 화학자들이 반응 에너지를 분석하는 데 도움이됩니다. 이주기는 일반적으로 다른 원소로부터 이온 성 화합물 형성에 대한 조사를 알려줍니다. 전체 반응 과정을 일련의 단계로 분해하여 전반적인 반응 과정을 명확하게합니다. 화학 반응 분석에 대한 이러한 접근 방식은 Hess의 법칙에서 비롯된데, 이는 개별 단계를 탐색 한 다음 그 효과를 결합하여 가장 중요한 에너지 변화를 결정할 수 있다고 명시합니다.
격자 에너지가 Born-Haber 사이클 방정식의 일부를 형성하므로 다른 요소가 연결될 때이를 해결할 수 있습니다. 방정식은 다음과 같이 읽습니다.
.형성 열 =격자 에너지 + 분무 열 + 해리 에너지 + (이온화 에너지의 합) + (전자 친화도)
Born-Haber주기는 Hess의 법칙을 적용하여 주어진 이온 성 화합물의 엔탈피 형성 변화를 성분으로부터 기체 이온을 형성하는 데 필요한 엔탈피로의 형성 변화를 병치하여 격자 에너지를 계산합니다.
.다른 격자 에너지의 다른 응용
과학자들은 전자 관계와 불소 관계를 평가하기 위해 격자 에너지를보다 광범위하게 사용합니다. 요인은 차례로 다른 이온 고체의 상대적 강도에 대한 조사와 이온 성 화합물 정체성, 성분 및 특성에 대한 예측에 정보를 제공합니다.
추가 격자 에너지 계산의 예
예 :근사 기술 사용
먼저, 우리는 전하 변수를 해결하는 연습을합니다.
문제 1 : 화합물 MGO가 주어지면 결합 된 전하를 결정하십시오.
해결하기위한 단계 :
1. 이온의 전하를 쓰십시오 :Mgand o
2. (2) x (-2) = -4
문제 2 : 화합물 KCl이 주어지면 결합 된 전하를 결정하십시오.
1. 이온의 요금을 씁니다 :Kand Cl
2.이 요금에 다음과 같은 요금을 곱하십시오. (1) x (-1) =-1
논의 된 바와 같이 MGO의 -4 전하를 KCL의 -1 충전과 비교할 수 있습니다. 전자는 후자의 양의 4 배이므로 격자 에너지가 약 4 배 더 크다는 것을 예측할 수 있습니다.
이제 우리는 크기 변수를 해결하는 연습을합니다.
문제 3 : 화합물 CAO가 주어지면 이온의 크기를 결정합니다.
해결하기위한 단계 :
1. 양이온의 이온 반경 결정 :Ca는 이온 반경이 0.100 nm입니다.
2. 음이온의 이온 반경을 결정하십시오 :O는 이온 반경이 0.140nm입니다.
우리는 이러한 값을 논의 된 바와 같이 다른 이온 성 화합물의 값과 비교할 수 있습니다. 이것은 더 큰 격자 에너지를 나타내는 통찰력을 제공합니다.
Born-Haber 사이클 예
이제 우리는 Born-Haber주기를 사용하여 정확한 격자 에너지를 해결하는 연습을 할 것입니다.
문제 1 : 화합물 NaCl이 주어지면 격자 에너지를 결정하십시오.
해결하기위한 단계 :
- 정상적인 조건 하에서 NaCl의 형성을 설명하는 반응을 작성하십시오.
na (s)+12Cl 2 (g) → NaCl (s)
- 반응물을 이온 가스 성분으로 바꾸십시오.
NA (S) → NA (G)
Na (g) → Na+(g)+e -
12CL2 (G) → CL (G)
cl (g)+e- → cl- (g)
Na+(G)+Cl- (G) → NaCl (S)
이 최종 변환은 "격자"화합물 자체의 생성을 보여줍니다.
3. Hess의 법칙에 따라 반응의 일부를 분리하고 그것들을 분리하여 고려하십시오.
.
NaCl (S) → Na (S)+12Cl 2
−Δh f, NaCl (s) =+411 KJ
Na, Δ =107 kJ
Na (g) → Na+(g)+e-
즉, 1, na (g) =502 kj
12cl 2 (G) → CL (G)
12Δh 결합, cl2 (g) =12 × 242 kj
cl (g)+e- → cl- (g)
EA1, Cl (g) =-355 kj
Na+(G)+Cl- (G) → NaCl (S), ΔH 격자 =?
4. 최종 Born-Habor Cycle 방정식을 제공하기 위해이 부분을 다시 소음시킵니다.
0 =ΔHcycle =ΔHF, NaCl (S)+ΔHSUB, Na+IE1, NA (G)+12ΔHBond, Cl2 (g) -EA1, Cl (g) - ΔHlattice
그런 다음 격자 변수를 해결하십시오 :Δhlattice, naCl (s)
=- [411+107+502+12 (242) -355] kj
NaCl의 격자 에너지 =-786 kj







