헌드의 규칙은 무엇입니까?
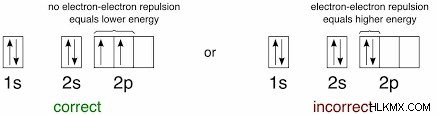
Hund의 규칙이라고하는 가장 일반적으로 헌드의 최대 다중 규칙은 Sublevel 내의 모든 원자 궤도가 단독으로 점유되기 전에 을 차지하고 있다고합니다. 그리고 그 모든 단독으로 점유 된 궤도는 같은 스핀을 가진 전자를 가지고 있습니다 . 전자는 같은 궤도에서 다른 전자와 짝을 이루기 전에 항상 자신의 아부 궤도를 차지합니다.
이 규칙은 전자 구성과 분자 궤도 다이어그램을 모두 구성 할 때 유용합니다.
헌드의 행동 규칙
올바른 사용법
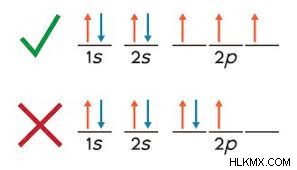
Hund의 규칙을 사용할 때 저지른 가장 일반적인 실수는 필요한 전자가 필요하기 전에 이중으로 짝을 이루는 것입니다. p 궤도를 채울 때, 각각의 하위 궤도에 하나의 전자가 가질 때까지 전자를 짝을 이루어서는 안됩니다. 모든 궤도에 단일 전자가 있으면 다시 왼쪽에서 시작하여 반대쪽 스핀의 전자와 쌍을 이루십시오. 모든 전자가 설명되면 구성이 완료됩니다!
전자 구성 예 :질소
질소에 대한 박스 전자 다이어그램의 예를 살펴 보겠습니다 :
| N |  1s 1s |  2s 2s |    |
| o |  1s 1s |  2s 2s |    |
| CL |  1s 1s |  2s 2s |    2p 2p |  3s 3s |    |
 1s
1s  2s
2s  2p
2p 

 3s
3s  4s
4s