핵심 개념 - 화학의 두더지
그래서 두더지는 무엇입니까? 이 튜토리얼에서는 화학에서 중요한 측정 단위 인 두더지의 정의를 배우게됩니다. Avogadro의 번호와 유용한 이유에 대해서도 배우게됩니다. 여기에서 화학 문제 해결에 이러한 개념을 사용할 수 있습니다.
다른 기사에서 다루는 주제
- 차원 분석
- 분자 대 화합물
- 화학 방정식 균형
두더지와 Avogadro의 숫자 정의
두더지 또는 "몰"은 화학에서 측정 단위로, 매우 많은 수의 분자, 원자 또는 입자를 지정하는 데 사용됩니다. 이 매우 많은 수는 Avogadro의 숫자라고합니다 :6.02214 x 10, 두더지의 단위 수입니다. 이 숫자는 요소의 수량에 대해 알려주는 데 매우 중요합니다. 물질의 두더지는 물질 몇 그램에서 수백 그램까지 어디에나있을 것입니다.
두더지의 적용
요소의 두더지
한 두더지의 요소를 살펴 보겠습니다. 단일 몰에서는 원소에 관계없이 6.02214 x 10 원자가 있습니다. 이것은 1 몰의 수소가 6.02214 x 10 수소 원자를 함유하고 1 mol의 염소는 6.02214 x 10 염소 원자를 함유한다는 것을 의미합니다. 두더지에는 실험실 작업에서 화학 방정식 균형에 이르기까지 모든 수준의 화학에 걸쳐 수많은 응용이 있습니다. 실제로 살펴 보겠습니다.
화합물의 두더지
화합물, 염화나트륨 - NaCl의 두더지를 살펴 보겠습니다. NaCl의 두더지는 Avogadro의 염화나트륨 분자를 가질 것입니다. 염화나트륨 몰에는 나트륨 원자와 염소 원자의 두더지가 들어 있습니다.
.원소, 분자 및 화합물의 두더지
요소가 계수로 작성되면 해당 계수는 해당 요소의 두더지 수를 알려줍니다. 예를 들어, 2C를 쓰면 2 mol의 탄소가 있음을 의미합니다. 다시 말해, 2 몰의 탄소 원자가 있습니다. 우리는 이미 하나의 요소에 6.02214 x 10 원자 (Avogadro의 숫자)가 포함되어 있기 때문에 2 개의 두더지는 2 * 6.02214 x 10 원자 =12.04428 x 10 탄소 원자와 동일합니다. 계수에 대한이 아이디어는 화학 방정식에서 많이 나타납니다.
주어진 분자 또는 화합물에서 요소에 첨자가있는 경우, 첨자는 분자의 한 몰에서 원소의 두더지를 알려줍니다. 분자의 두더지와 분자 내 요소의 몰 사이의 미묘한 차이점에 주목하십시오. 원소의 두더지의 수는 더 큰 분자에서 해당 요소의 두더지와 다를 수 있습니다. 이것은 언뜻보기에 혼란스러워 보이지만 몇 가지 예를 보면 도움이 될 것입니다.
화학에서 몰수 이해의 예
- 분자 o 2 를 참조하십시오
- 화합물의 계수는 1이기 때문에, 우리는 분자 1 몰 O 2 로 작업하고 있습니다.
- 1 Mole of o 2 =6.02214 x 10 분자 O 2
- 원자 O는 첨자 2를 가지므로 분자에 두 몰의 O 원자가 있음을 의미합니다.
- 2 몰의 O =2 * 6.02214 x 10 원자 =12.04428 x 10 산소 원자
2. 화합물 분석을 시도해 봅시다 : ch 4
- 계수는 1이기 때문에 우리는 1 몰의 화합물 ch 4 로 작업하고 있습니다.
- 1 Mole of Ch 4 =6.02214 x 10 분자 ch 4
- 화합물 내에 첨자가 1
- 이기 때문에 1 몰의 C가 있습니다.
- 1 Mole of C =6.02214 x 10 원자 C
- 화합물 내에 4 몰의 H가 있습니다. 첨자는 4
- 이기 때문입니다.
- 4 몰의 H =4 * 6.02214 x 10 원자 =24.08856 x 10 원자 H
3. 도전적인 것은 다음과 같습니다. 3nacl
- 화합물의 계수는 3이기 때문에, 우리는 3 몰의 화합물 NaCl
- 로 작업하고 있습니다.
- NaCl의 3 몰 =3 * 6.02214 x 10 분자 NaCl
- 화합물 내에 3 mol na가 있습니다 (계수는 원자에도 분포됩니다!)
- NaCl의 3 몰 =3 * 6.02214 x 10 =18.0663 x 10 Na의 원자
- 화합물 내에 3 mol cl
- 가 있습니다
- NaCl의 3 몰 =3 * 6.02214 x 10 =18.0663 x 10 Cl의 원자 >
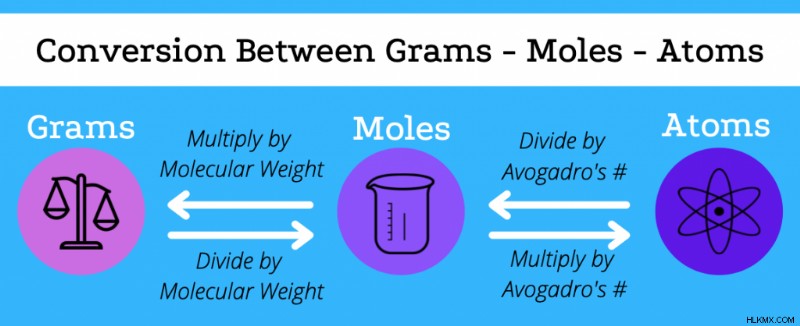
그램에서 두더지로 변환
그램에서 두더지로 전환 할 수도 있고 그 반대는 요소 또는 화합물의 분자량을 사용하여 그 반대도 마찬가지입니다. 화합물의 분자량은 원소 성분의 분자량의 합입니다.
- 화합물의 두더지가 주어지면 그램을 찾으려면 곱하기 분자량으로.
- 화합물의 그램을 주었을 때 두더지를 찾기 위해 분할 분자량으로.
그램이 주어진 분자의 원자를 찾으려면 먼저 분자량을 사용하여 두더지로 전환 한 다음 Avogadro의 숫자를 가진 원자로 전환해야합니다.
 그램 변환의 예
그램 변환의 예 - 9.2 몰의 No
2 에 몇 그램이 몇 그램입니까? ?
- No
2 의 분자량 46 g/mol
입니다 - 1.2 몰에서 그램을 찾으려면 분자량으로 나눕니다!
- 9.2/46 =0.2 그램 No
2
- 9.2/46 =0.2 그램 No
2. 1.5 그램의 CO에 얼마나 많은 원자가 있습니까?
- 먼저 분자량
- 를 사용하여 CO 그램을 두더지로 변환합니다.
- Co의 분자량은 28 g/mol 입니다
- Moles CO =1.5 * 28 g/mol =42 Moles
- 원자 수를 찾으려면 Avogadro의 수를 곱하십시오.
- 원자 Co =42 몰 * 6.02214 x 10 =252.93 x 10 원자 Co
추가 읽기
화학의 두더지와 Avogadro의 숫자에 대해 배우는 데 감사드립니다. 보다 일반적인 화학 주제는 아래 기사를 참조하십시오!
- 규정형 요소
- 화학 결합이란 무엇입니까
- 화학량 론적 문제 해결
- 산화 환원 반응의 균형을 잡는 방법