핵심 개념
이 튜토리얼에서는 약한 산과 약한베이스에 대해 배우게됩니다 그들이 약한 것으로 간주되는 이유와 각각의 예를 포함하여. 우리는 또한 당신에게 약산과 가장 약한베이스 목록을 보여줄 것입니다.
다른 기사에서 다루는 주제
- 강산 및 염기
- 루이스 산과베이스
- 산 기본 이론
- 산 기본 화학
- 산 및 염기의 특성
산이나 염기를 '약한'것으로 만드는 것은 무엇입니까?
약산
산 약이 약한 이유에 대해 생각할 때 해리 속성에 대해 생각하십시오. 그들이 용액에 용해 될 때, 약산은 다른 구성 이온에 완전히 분리되지 않습니다. 또한, 약산이 물에 용해 될 때, 약산 자체의 농도와 그의 구성 이온 사이에 평형이 발생한다. 약산은 용액에서 완전히 이온화되지 않았다 .
예를 들어, 히드로 플루오산, HF는 약산이다. 물에 용해 될 때, HF 이온은 H와 평형에 존재하며, 이는 물과 반응하여 히드로 늄 및 F 이온을 형성한다. 산이 이온 성분으로 완전히 분리되지 않기 때문에 약한 산입니다.
ha + h 2 o 3 h 3 o + a
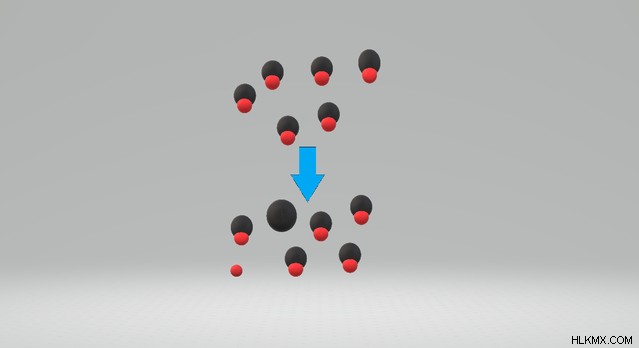
강산은 몇 가지뿐입니다. 강산을 배우고 암기하면 다른 모든 산이 약산이라고 가정 할 수 있습니다. 또한, 산 해리 상수, KA 또는 PKA 값을 보면 강한 산을 약한 산과 구별 할 수 있습니다. 강산은 KA가 높고 PKA 값이 낮고 약한 산에는 작은 ka 및 높은 PKA 값이 있습니다 .
약한베이스
이 개념은 약한 기초에 대해 생각할 때 매우 유사합니다. 그러나,이 경우, 약한 염기는 용액에서 수소 이온을 완전히 이온화하거나 완전히 받아 들일 수없는 염기이다. 염기는 산과 반응하여 산 염기 쌍을 형성하기 위해 용액에 분리되어야한다; 베이스가 구성 이온으로 분해되지 않으면 필요한 방식으로 반응 할 수 없습니다. 물에 용해 될 때, 용액은 소량의 수산화 이온과 다량의 해제되지 않은 염기를 함유한다. 약한베이스는 완전히 이온화되지 않습니다.
예를 들어, 수산화 암모늄, NH <서브> 4 아,베이스의 상대방은 nh 4 입니다 그리고 오; nh 4 아마도 용액에서 산성 수소를 받아들입니다. 그러나, 약한 염기에서, 이들 이온은 완전히 분리되지 않으므로 nh 4 의 혼합물이있다. 아, 산베이스 쌍.
b + h 2 o
기본 해리 상수 KB에 의해 강한베이스를 약한베이스와 구별 할 수 있습니다. 이 변수는 수학적으로 기본 강도를 나타냅니다. 베이스가 약할수록 KB 값이 작습니다 .
예 - 아세트산은 강하거나 약합니까?
아세트산은 KA 값이 1.8 x 10입니다. ka는 상당히 작기 때문에 아세트산은 약한 산 입니다. 그리고 그것은 물에서 완전히 이온화되지 않습니다.
약산 및 염기의 예
약산 목록
약산은 주로 용액의 완전한 분자로 남아 있습니다. 산 분자의 작은 부분만이 이온으로 "분해"되거나 분리됩니다. 그러나 이러한 "약산"은 여전히 부식성이 높고 위험 할 수 있습니다. 이것은 약산 예의 짧은 목록이지만 더 많은 것이 있습니다!
- 포름산 (Hcooh)
- 아세트산 (ch 3 COOH)
- 벤조산 (c 6 h 5 COOH)
- hydrofluoric acid (HF)
- 인산 (H 3 po 4 )
- 황산 (H 2 그래서
3 ) - 카본 산 (H 2 Co 3 )
- 아질산 (hno 2 )
- 수소 세포 산 (HCN)
- Hydrosulfuric acid (H 2 s)
- Citric Acid (c 6 H 8 o 7 )
약한 염기 목록
다음은 약한 기본 예제의 목록입니다. 많은 약한 염기는 수산화 마그네슘과 같이 약간 가용성 수산화물이며, 다른 것들은 유기 화합물입니다.
- 수산화 암모늄 (NH <서브> 4 오)
- aniline (c 6 h 5 nh 2 )
- 암모니아 (nh 3 )
- 메틸 아민 (ch 3 nh 2 )
- 에틸 아민 (ch 3 ch 2 nh 2 )
- 수산화 알루미늄 (Al (OH)
3 ) - 수산화 마그네슘 (Mg (OH)
2 ) - 피리딘 (C 5 h 5 n)
- 중탄산 나트륨 (Nahco 3 )
가장 약한베이스는 무엇입니까?
물은 약산과 약한 염기로 간주 될 수 있습니다. 왜냐하면 수소 이온과 수산화 이온을 모두 제공하기 위해 약간 이온화하기 때문입니다. 확실히 가장 약한 기지 중 하나입니다!
강산과 강한 염기의 염은 용액을 생성하는 용액은 중립으로 간주됩니다. 과염소산나트륨, 염화나트륨 및 질산 나트륨이 그 예입니다. 우리는이 화합물을 약한 염기가 아닌“중립”으로 분류 할 것입니다.
실제 응용 분야의 약산 및 염기
- 약산 및 염기는 일반적으로 유기 화학 및 생화학에 사용되어 완충 용액을 만들거나 적정에 적정하거나 특정 반응을 촉진하기 위해 사용됩니다.
- 아세트산은 식초에서 볼 수있는 활성 성분입니다.
- 벤조산은 많은 식물에서 자연적으로 발생하며 일반적으로 식품 보존에 사용됩니다.
- 암모니아는 가정용 청소 용품, 벌레 기충제, 비료 등에서 볼 수 있습니다.

강한 대 농축 및 약한 대 희석
강산 또는 염기 대 농축 된 것, 그리고 약산 또는 염기 대 희석에 대해 생각할 때주의해야합니다. 농축 된 산은 물이 많은 용액을 의미하며 희석 된 산은 많은 양의 용매를 갖는 용액을 의미합니다. 베이스가 높은 농도를 가지고 있다고해서 강력하다는 것을 의미하지는 않습니다. 그리고 기지가 매우 희석되어 있기 때문에 약하고 위험한 기초라는 것을 의미하지는 않습니다.
추가 읽기
- PKA는 무엇입니까?
- PH는 무엇입니까?
- 버퍼 솔루션
- 평형 상수
- 산 염기 중화 반응
- 다발성 산