Beer-Lambert 법률에 따르면 샘플에 흡수되는 빛의 양은 광이 통과하는 샘플의 부피와 샘플의 농도와 직접 관련이 있다고합니다. 그것은 또한 맥주의 법칙이라고도합니다.
Beer-Lambert 법률은 무엇입니까?
Beer-Lambert 법률은 샘플의 농도를 샘플이 샘플을 통과 할 때 흡수하는 빛의 양과 관련시킵니다. Beer-Lambert 법의 방정식은 일반적으로 다음과 같이 작성됩니다.
a =ϵlc
a =흡광도
ϵ =어금니 멸종 계수
l =경로 길이
C =샘플의 농도
흡광도는 샘플에 들어가 샘플을 떠나는 빛의 강도의 비율과 관련이 있습니다.
a =log 10 (i 0 /i)
i 0 =샘플 전 빛의 입사 광 강도
i =전송 빛 - 샘플 이후의 빛의 강도
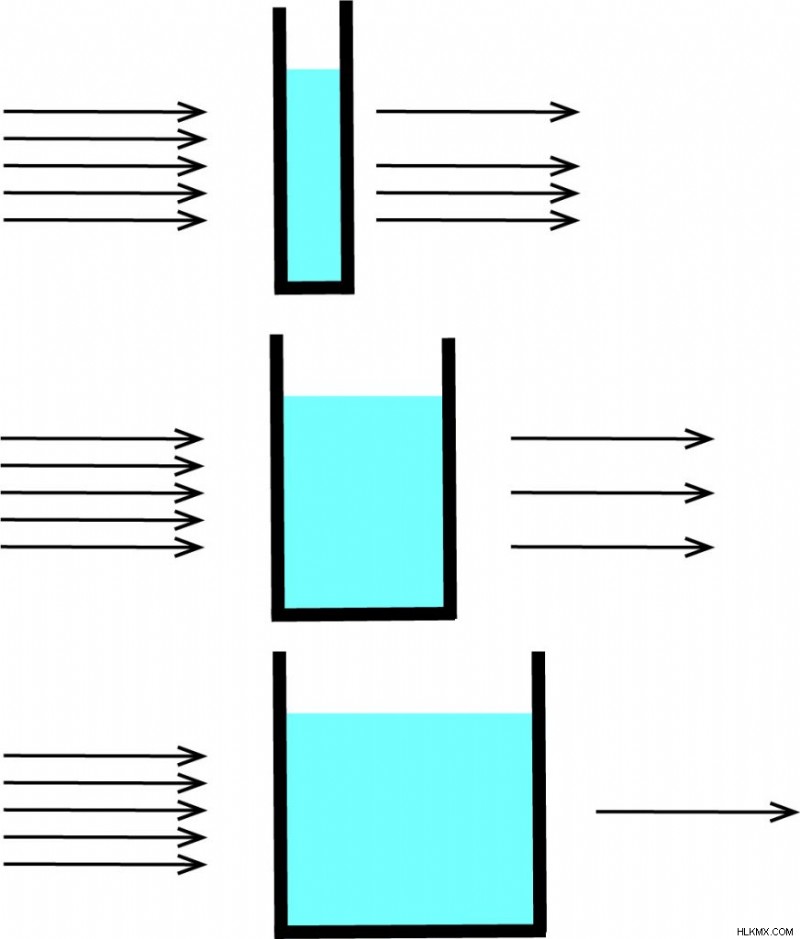
Beer-Lambert 법칙은 일반적으로 샘플의 흡수 및 전송 측정에 사용되며 샘플의 농도를 결정하는 데 사용될 수 있습니다. 흡수 측정에서, 빛은 샘플로 채워진 큐벳을 통과합니다. 큐벳 후 빛의 강도는 큐벳을 통과하기 전에 빛과 비교됩니다. 큐벳의 크기는 경로 길이 (L)를 결정합니다. (Cuvette는 특수 유리 제품입니다.) Cuvette가 넓을수록 빛이 통과되는 샘플이 많고 전송 된 빛이 더 낮습니다. 이것은 방정식이 경로 길이 (L)에 의존하는 이유를 설명합니다.
어금니 멸종 계수는 무엇입니까?
어금니 멸종 계수는 모든 화학 물질과 맥주-램버트 법의 중요한 변수에 특화되어 있습니다. 어금니 멸종 계수는 물질이 얼마나 많은 빛을 흡수하고 파장에 특이 적입니다. 또한 때로는 어금니 흡수 계수 또는 몰 흡수성이라고도합니다. 방정식에서, 그것은 가장 자주 엡실론으로 상징됩니다.
어금니 멸종 계수의 단위는 가장 일반적으로 MCM입니다. 단위는 경로 길이와 샘플 농도의 단위와 일치해야합니다. 그렇게하면 흡광도는 단위가없는 숫자를 초래합니다. 그래프에서, 흡광도는 종종 A.U.의 단위로 작성되며, 이는 임의의 단위를 나타냅니다.
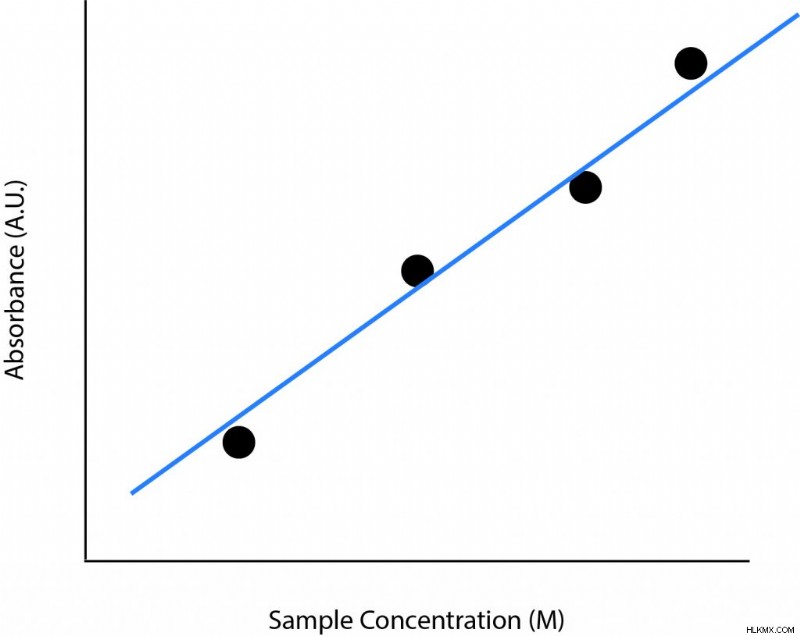
Beer-Lambert Law Graph
Beer-Lambert 법칙을 보여주는 전형적인 그래프는 선형적이고 양의 상관 관계가 있습니다. X 축에는 농도 단위가 있고 Y 축은 흡광도가됩니다. 이는 방정식의 다른 두 변수, 어금니 멸종 계수 및 경로 길이가 일정하게 유지됨을 나타냅니다. 농도가 증가함에 따라 흡광도도 증가 할 것입니다. 이 패턴은 농도가 증가하면 빛을 흡수하고 흡수를 증가시키기 위해 더 많은 분자가 있기 때문에 의미가 있습니다.
아래는 Beer-Lambert 법을 보여주는 것과 유사한 그래프입니다. 여러 가지 다른 농도가 측정됩니다. 그런 다음이 점에 줄을 맞추십시오. 선의 기울기는 경로 길이가 어금니 멸종 계수의 시간입니다. 경로 길이를 알고 있다면 어금니 멸종 계수를 쉽게 결정할 수 있습니다. 어금니 멸종 계수는 선의 기울기가 경로 길이로 나뉘어집니다.
Beer-Lambert Law의 적용
Beer-Lambert 법칙은 일반적으로 요오드 시계 반응과 같은 실험에 중요한 알려지지 않은 농도 샘플의 농도를 결정하는 데 일반적으로 사용됩니다. 이를 위해, 알려진 농도의 다수의 샘플의 첫 번째 흡광도가 측정된다. 분광계 가이 측정을 만듭니다. 이 포인트는 라인에 맞습니다. 라인은 어금니 멸종 계수의 경사가 경로 길이의 시간을 갖습니다. 이것을 경로 길이로 나누면 어금니 멸종 계수가됩니다. 알 수없는 샘플의 흡수를 측정 할 수 있습니다. 흡수는 경로 길이로 나뉘어 진 멸종 계수가 샘플의 농도를 제공합니다.
법의 한계
법은 고농도에서 부정확 해지는 경향이 있습니다. 이것은 다른 요인의 조합 때문입니다. 용액의 굴절률이 벗어날 수 있습니다. 관심 분자가 서로 상호 작용하기 때문에 포화 및 응집 효과가 있습니다 (저농도의 상황과 마찬가지로 용매뿐만 아니라). Beer-Lambert 법의 한계를 테스트하는 훌륭한 방법은 샘플에 대해 점점 더 높은 농도에서 농도 구절 흡수 플롯을 만드는 것입니다. 플롯은 선형이어야하지만 고농도는 선형이 멈출 것입니다. 이 시점에서 고농도는 법이 부정확하게 발생합니다.
Beer-Lambert 법의 한계를 테스트하는 훌륭한 방법은 샘플에 대해 점점 더 높은 농도에서 농도 구절 흡수 플롯을 만드는 것입니다. 플롯은 선형이어야하지만 고농도는 선형이 멈출 것입니다. 이 시점에서 고농도는 법이 부정확하게 발생합니다.
예제 문제
예제 문제 #1 :당신은 알려지지 않은 농도의 로다민 염료 용액이 있습니다. 분광계를 사용하면 흡수를 9048 로 측정합니다. 로다민의 어금니 멸종 계수는 116000 cm입니다. 사용한 큐벳은 경로 길이가 1cm입니다. 샘플의 농도는 얼마입니까?
예제 솔루션 #2 : 여기서 우리는 Beer-Lambert 법에서 C의 가치를 결정하려고 노력하고 있습니다. 그래서 우리는 우리가 찾고있는 변수를 해결하기 위해 방정식을 재정렬하여 시작합니다
a =ϵlc
c =a / ϵl
그런 다음 값을 연결하기 시작할 수 있습니다. 우리의 집중력이 어금니 단위와 함께 나오도록 단위에주의를 기울여야합니다.
C =9048 / (1 cm * 116000 cm m)
C =9048 / 116000 m
0.078 m =c
미지의 용액의 농도는 0.078m입니다.