촉매는 반응 속도가 전적으로 반응에서 혼합되지 않거나 소비되는 물질에 의해 영향을받는 과정이며 최종 생성물에 영향을 미치지 않는 과정이다. 이 과정에는 기능 그룹이 다른 복잡한 유기 물질이 포함됩니다. 반응 속도는 반응물의 화학적 특성, 온도, 조건 등과 같은 다양한 요인에 의존합니다. 촉매와 관련된 특정 물질은 그 반응에서 소비하지 않고 생산을 증가시키는 촉매입니다.
.역사
촉매이라는 용어는 1835 년 Jacob Berzelius에 의해 주어졌습니다. 18 세기에서 19 세기에 여러 과학자들은 다른 반응에서 촉매 과정을 관찰했으며, 촉매로 사용되는 다른 물질을 발견했습니다. 촉매의 첫 번째 관찰은 Kirchhoff에 의해 산에 의한 설탕으로 전분을 전환시키는 데에 의해 기록된다. Michael Faraday 경은 기체 수소와 산소의 재조합에서 백금의 힘을 발견했습니다.
촉매의 원리
촉매는 다음과 같은 점에 의해 이해 될 수있다 :
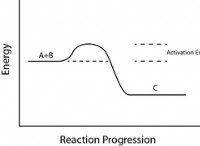
반응에 촉매가있을 때, 전이 상태에 도달하기 위해 자유 에너지가 적을 것이다. 촉매의 작동은 반응의 환경을 조정합니다. 촉매는 환경의 열을 증가시키는 데 도움이 될 수 있고, 시약을 결합하여 결합을 분극하고, 시약의 해리 및 결합의 형성 및 결합의 파괴에 도움이됩니다.
.촉매의 작동은 Arrhenius 방정식에 의해 이해 될 수 있으며, EA 인 캐비테이션 에너지는 주어진 온도에서 속도 상수 k의 값을 결정한다. 촉매가 배급에 추가되면 활성화 에너지가 줄어 듭니다. 따라서, 그것은 낮은 활성화 에너지에서 발생한 반응의 메커니즘을 제공합니다.
촉매 유형
촉매에 사용되는 두 가지 주요 유형의 촉매가 있습니다
- 이종 촉매
- 균질 촉매
이종 촉매
이종 촉매는 다른 반응물 상태와 함께 작용하는 촉매입니다. 촉매가 고체 인 경우 액체 및 기체 반응물과 함께 작동합니다. 이 촉매의 활성 부위는 표면에 있습니다. 반응물은 이들 촉매의 표면에 흡착 된 다음 그들과 상호 작용한다. 촉매의 대부분은 고체입니다. 예는 제올라이트, 알루미나, 흑연, 전이 금속 산화물, 레네이 니켈, 바나듐 산화물 등이있다.
반응 메커니즘은 흡착에 따라 다양합니다. 촉매의 표면적은 반응에 영향을 미칩니다. 촉매의 크기가 작을수록 표면적이 클수록.
예를 들어 Haber 프로세스가 있습니다. 철은 질소 및 수소로부터 암모니아의 생성에서 촉매로 작용한다. 반응에서, 가스는 철의 표면에 흡착된다.
N2 (g) + 3H2 (g) 2NH3 (g)
이 반응에서, 반응물 및 생성물은 기체상에 있고, 촉매 Fe는 고체상에있다.
균질 촉매
균질 촉매는 동일한 단계와 같은 단계에서 작동합니다. 촉매가 고체 인 경우, 고체 반응물과 다른 단계에서도 동일하게 작동합니다. 이들 촉매는 용매에 용해 될 수있다. 예는 히드로 일릴 화 및 수경식이다.
카르 복실 산의 에스테르 화 과정에는 수소 이온이 필요합니다.
전이 금속은 항상 촉매로 사용됩니다. 그러나, 일부 유기 물질은 또한 촉매로 작용한다. 그것들은 유기 촉매라고 불리며 균질 한 촉매하에옵니다.
예를 들어 CH3COOCH3 (L) + H2O (L) CH3COOH (L) + CH3OH (L)
이것은 HCl에 의해 촉매되는 메틸 아세테이트의 가수 분해 반응이다. 여기서 모든 반응물, 생성물 및 촉매는 액체 상태에 있습니다.
촉매의 중요성
소량의 촉매는 반응에 큰 변화를 줄 수 있습니다.
많은 제품이 제조 될 때 환경에 해를 끼치는 많은 양의 부산물을 생산합니다. 촉매는 최종 생성물의 양을 증가시키고 부산물의 수를 감소시킵니다. 따라서 그것은 유해 폐기물로부터 환경을 절약합니다.
그들은 반응에서 소비하지 않으며 반응이 완료된 후 반응물에서 출발합니다. 따라서 그들은 제품에 영향을 미치지 않습니다.
결론
촉매는 환경, 화학, 산업 등과 같은 많은 영역에서 중요한 역할을합니다. 생물학적 및 화학적 촉매제입니다. 그것들은 물질 상태에 따라 두 가지 유형으로 나뉩니다. 하나는 균질하고, 두 번째는 이종 촉매입니다. 반응 속도를 높이는 데 도움이됩니다. 그들은 또한 우리 몸에서 일어나는 다양한 반응에 도움이됩니다.