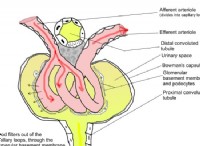
Mohr의 소금은 독일 화학자 Karl Friedrich Mohr의 이름을 따서 명명되었으며, 그 요소를 발견했습니다. 물에 용해 될 때, Mohr의 소금 (및 대부분의 황산염 소금)은 화학적 공식 [Fe (H2O) 6] 2+와 아쿠오 복합체를 생성하기 위해 용해됩니다. 또한이 Aquo 복합체의 분자 기하학은 본질적으로 팔면체입니다. Mohrite는 자연에서 가장 일반적으로 볼 수있는 Mohr의 소금의 미네랄 형태입니다.
Mohr의 소금 결정 구조
Mohr 's Salt를 포함한 Tutton의 소금은 총체적으로 Tutton의 소금 (또는 경우에 따라 Schonites)이라고하는 이중 황산염 그룹입니다. 이 패밀리의 모든 구성원 (Mohr 's Salt 포함)은 가장 일반적인 유형 인 모노 클리닉 지오메트리로 결정을 형성하는 것으로 알려져 있습니다. Mohr의 소금 분자 구조의 결합 패턴은 [Fe (H2O) 6] 2+ 중심으로 구성된 팔면체 중심의 존재를 특징으로합니다. 또한이 중심은 각각 암모늄 및 황산염 이온과 수소 결합을 생성하는 것으로 나타났습니다.
Mohr의 소금 제작
Mohr의 소금을 만드는 것은 간단한 과정입니다.
작은 양의 황산을 함유하는 물에서 황산 암모늄 및 수화 된 철 황산염 (등몰비로 결합)의 용해는 실제로 Mohr의 소금을 준비하는 가장 일반적인 방법입니다. Mohr의 소금의 연한 녹색 결정을 얻기 위해,이 생성 된 용액은 결정화 과정으로 처리 된 후 증발된다. 소금이 가열되면 이온화가 발생하여 모든 양이온과 음이온이 염으로부터 방출 될 수 있습니다. 니켈, 마그네슘, 아연, 납 및 망간은 모두 Mohr의 소금 및 기타 요소에서 볼 수있는 일반적인 오염 물질입니다. 이 오염 물질의 대부분은 과거에 동형 염을 만드는 것으로 나타났습니다.
황산 황산의 가수 분해를 방지하기 위해, 희석 된 황산은 일반적으로 방부제로 사용된다. 절대적으로 필요하지 않은 한, 염 혼합물을 물에 용해시킬 때 과도한 가열은 일반적으로 피해집니다. 이것은 Fe2+ 이온 (색상의 연한 녹색)을 Fe3+ 이온으로 변환하는 것을 방지하기 위해 수행되며, 그렇지 않으면 (일반적으로 노란색) 발생합니다. 황색 용액이 얻어지면 절차를 반복해야합니다. 냉각 후 결정이 분리되지 않으면 결정 형성을 장려하기 위해 농축 용액에 Mohr의 소금 몇 가지 결정을 추가 할 수 있습니다. 일반적으로 이것은 "파종"이라고합니다.
응용
Mohr 's Salt에는 다양한 응용 분야가 있습니다.
분석 화학 영역에서, Mohr 's Salt는 다양성 (또는 철 이온)으로 인해 Fe2+ 이온의 공급원으로서 가장 널리 사용되는 화합물 중 하나입니다. 철 이온의 공급원 으로서이 고체를 사용하는 장점은 비교적 긴 유적 수명을 가지며 환경에 노출 된 결과로 산화에 내성이 있다는 것입니다. 주변 환경의 pH가 높을 때,이 물질의 산화는 낮을 때보 다 더 빨리 발생한다는 것이 알려져있다 (배지는 다소 기본적이다). Mohr의 소금 용액은 일반적으로 약간 산성이므로 앞서 언급 한 바와 같이 암모늄 양이온의 존재에 기인 할 수 있습니다. 명심해야 할 또 다른 점은 황산이 제 2 철 이온에 대한 철 이온의 산화가 발생하는 것을 막기 위해 Mohr의 소금 용액에 첨가 될 수 있다는 것입니다. 고용량의 감마 방사선을 모니터링하는 데 사용되는 Fricke의 선량계에 Mohr의 소금을 사용하는 것은 화합물의 또 다른 주목할만한 적용입니다.
결론
NH4+ 및 Fe2+는이 화합물에 존재하는 것으로 알려진 주요 양이온, 즉 암모늄 양이온 (NH4+로 표시) 및 철 양이온 (Fe2+로 표시)이다. 따라서 Mohr의 소금은 황산 암모늄과 황산 황산염으로 구성된 이중 소금으로 생각할 수 있습니다. 중요한 것은 실험실에서 Mohr의 소금은 결정화가 쉽게 발생 하고이 시약에 의해 생성 된 결정이 공기에 노출 될 때 산화에 매우 저항력이 있다는 사실로 인해 일반적인 시약이라는 사실입니다.
.