수소 원자의 음이온을 수 소화물이라고합니다. 수소 원소는 주기율표에서 다양한 원소와 반응 할 가능성이 있습니다. 수소 및 수소 화학 화합물의 친 핵성, 염기성 및 환원 특성은 각각의 화합물에서 발견 될 수있다. 몇 가지 고귀한 가스 외에도 주기성 테이블의 모든 요소는 몇 가지 희귀 가스를 제외하고 수 소화물 화합물을 만드는 데 사용됩니다.
수 소화물 이온과 원소 사이에 형성된 결합에 기초하여, 고려중인 특정 수 소화물 화합물의 특성을 설명 할 수있다. 분자의 분자 공식은 H이고, 분자량은 mol 당 대략 1.008g입니다. 수소 원자가 주기성 표의 VA 그룹에 속하는 원소와 반응하지 않는다는 것이 발견되었다. 수 소화물 갭은이 현상을 설명하는 데 사용되는 용어입니다.
수소 유형
수소는 수소 원자 및 형성되는 화학적 결합과 반응 할 수있는 원소의 유형에 기초하여 세 가지 유형으로 분류됩니다 :이온 수 소화물, 공유 수 소화물 및 금속성 또는 간질 수 소화물. 이온 수 소화물은 가장 흔한 유형의 수 소화물입니다. 이 섹션의 다양한 유형의 수평물을 간단히 살펴 보겠습니다. 수소 원자 사이의 화학적 결합이 고려 될 때, 수소 원자와 반응 할 수있는 요소의 유형을 고려할 때,이 수소는 세 가지 범주로 나눌 수 있습니다. 그것들은 다음과 같이 분류됩니다 :이온 수 소화물, 공유 히드 라이드, 금속 히드 라이드 및 간질 히드 라이드.
다음 섹션은 각 유형의 수 소화물에 대한 설명을 제공합니다.
이온 히드 라이드
이온 수 소화물은 첫 번째 유형의 분류이며 다음과 같이 분류됩니다. 이온 수 소화물은 슈도 할리드와 식염수 수 소화물로도 알려져 있습니다. 이들 전기 화합물은 알칼리 금속과 S 블록 요소와 수소 원자 사이의 반응의 결과로 형성되며, 이는 이온 성 수 소화물이 형성된다. 이들은 높은 수준의 활동으로 인해 주기성 테이블에서 가장 활발한 요소라고합니다. 그들은 고체 상태에 비해 액체 상태에서 다르게 행동하는 경향이 있습니다. 이온 수 소화물은 논의 될 첫 번째 분류 유형입니다. 이온 히드 라이드는 식염수 수 소화물 및 슈도 할리드 (Pseudohalides)로도 알려져 있습니다. 이들은 S 블록 요소 (알칼리성 축제 금속이라고도 함) 및 기타 알칼리 금속이 수소 원자와 반응하여 S 블록 요소 및 기타 알칼리 금속의 경우와 같이 전기성 화합물을 형성 할 때 형성된다. 이것들은 가장 활발한주기 테이블의 요소입니다. 액체 상태가 아닌 고체 상태에서 그들의 행동이 다릅니다.
이온 수 소화물은 고체 상태에서 비 휘발성, 비전도 및 비전도 인 결정질 물질입니다. 대조적으로, 이온 수 소화물은 액체 상태에있을 때 우수한 전기 도체이다. 양극은 또한 전기 분해에서 수소 가스 생산을 담당합니다.
MH (S)+H2O (L) → MOH (AQ)+H2 (g)
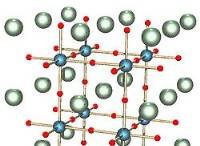
이온 수 소화물에는 수 소음 (NAH), 수 소화물 (KH), 수 소화물 (CAH2) 등과 같은 화합물이 포함됩니다. 이 카테고리는 모든 알칼리 금속 히드 라이드를 어떤 형태로도 포함합니다.
공유 수소
하나의 수소 원자가 하나 이상의 비금속 원소와 반응하여 공유 수 소화물이 형성 될 때 공유 수 소화물이 형성되어 공유 수소의 형성을 초래한다. 그룹 13 내지 17의 요소는 서로 공유 결합을 형성하지 않을 가능성이 높습니다. 이온 성 수 소화물의 형성과는 달리, 공유 수 소화물의 형성은 전기 양성 요소와 달리 전기 음성 요소로 발생한다. 이 위치에서 전자 쌍을 공유 할 수 있습니다. 공유 수 소화물은 존재할 수있는 또 다른 유형의 수 소화물입니다. 이들 공유 수 소화물은 하나의 수소 원자가 하나 이상의 비금속 원소와 반응하여 공유 수 소화물의 형성을 초래할 때 형성된다. 전형적으로, 그룹 13에서 17에 속하는 요소는 서로 공유 결합을 형성 할 수 있습니다. 이온 성 수 소화물과 달리, 전기 음성 요소가 서로 반응 할 때 공유 수 소화물이 형성된다. 이 위치에서 전자 쌍을 공유 할 수 있습니다. 반응에 따라, 공유 수 소화물은 휘발성 또는 비 휘발성 화합물로 분류 될 수 있습니다.
공유 수 소화물은 붕소 수 소화물, 질소 수 소화물, 실리콘 수 소화물 (식염수) 등과 같은 화합물을 포함합니다.
.금속 히드 라이드
금속성 또는 간질 수 소화물은 세 번째 유형의 수 소화물이며 가장 일반적입니다. 금속 수 소화물은 비 화학량 론적 조성물을 가지며, 이는 그들의 구별되는 특성 중 하나입니다. 전형적으로, 간질 수 소화물은 용액에서 전이 금속 원자와 수소 원자 사이의 결합의 형성에 의해 형성된다. 이 히드 라이드는 본질적으로 매우 단단하며 녹는 점과 끓는점이 매우 높습니다. 이 범주에서 다른 유형의 수 소화물이 발견됩니다. 간질 수소는 화학량 론적 조성물을 갖지 않습니다. 그것은 그들의 특징입니다. 전형적으로, 이들 간질 수소는 수소 원자와 하나 이상의 전이 요소 사이의 결합 형성의 결과로 형성된다. 비 쇄골 물질성 일뿐 만 아니라, 간질 또는 금속 히드 라이드는 자연 상태에서 매우 단단합니다. 그들은 각각 높은 끓는점과 높은 융점을 가지고 있습니다. D 블록 및 F 블록의 모든 요소는 전이 요소입니다. 그들은 전기를 전도 할 능력이 있지만 여러 가지 방법으로 이온 수 소화물과 다릅니다.
.수 소화물 마그네슘, 알루미늄 수 소화물 및 카드뮴 수 소화물을 포함한 다양한 유형의 금속 수소 가이 유형의 금속 수 소화물의 예인 것으로 간주되었다.
.바이너리 하이드 라이드
이러한 다양한 유형의 수 소화물 외에도 이진 수 소화물은 별도의 범주에 속하는 독특한 유형의 수 소화물입니다. 이진 히드 라이드에는 바륨 하이드 라이드, 알루미늄 수 소화물, 수 소화물, 수 소화물, 리튬 수 소화물 및 기타 원소와 같은 화합물이 포함됩니다. 이진 하이드 라이드는 수소 원자와 결합을 형성 할 수있는 원소를 함유하는 화합물이다. 화학 결합의 형성에 따라, 수소 원자는 전기 음성 종의 역할을 취한다. 이들 바이너리 하이드 라이드에 유리 수 소화물 음이온이 거의 없으므로 극히 드물게됩니다.
수소의 사용
존재하는 다양한 유형의 수 소화물에 대해 여러 화학 응용을 찾을 수 있습니다. 이러한 응용 프로그램 중 일부는 다음 섹션에 나열되어 있습니다.
- 리튬 알루미늄 수 소화물은 유기 화학에 사용될 수있는 강력한 환원제입니다.
암모니아는 다양한 산업에서 사용됩니다.
- 화학 공정과 관련하여, 포스 핀은 건물을 훈증하는 과정에서 필수 성분입니다.
금속 수 소화물에 대한 다양한 응용이 발견 될 수 있습니다. 그들은 수소와 열을 저장하고 압축기 역할을하는 등 다양한 목적으로 사용할 수 있습니다.
섬유 산업에서, 수경화는 건조 과정을 가속화하기 위해 건조제로 사용됩니다.
- hydrides는 다양한 응용 분야에서 감소 제로 널리 사용됩니다.
- hydrides는 니켈 금속 하이드 라이드 배터리와 같은 저장 배터리 기술의 개발에 필수적입니다. 리튬 이온 배터리를 포함하여 수소 경제의 전원 전기 자동차 및 기타 수소 경제에 대한 수소 저장으로 사용하기 위해 다중 금속 하이드 라이드가 조사되었습니다.
결론
수소 원자의 음이온은 수 소화물로 알려져 있습니다. 수소가 주기율표의 다른 요소와 접촉하면 반응합니다. 수소 및 수 소화물의 화학적 화합물은 다른 특성들 중에서 친 핵성, 환원 및 기본 특성을 나타낸다. 몇 가지 고귀한 가스를 제외하고, 수 소화물 화합물은 주기율표의 모든 요소로 형성 될 수 있습니다. 수평물은 수소 원자 및 형성되는 화학적 결합과 반응 할 수있는 원소의 유형에 따라 세 가지 유형으로 분류됩니다 :이온 수 소화물, 공유 수 소화물 및 금속 또는 간질 수 소화물. hydrides는 니켈-금액 히드 라이드 배터리와 같은 저장 배터리 기술의 개발에 필수적입니다. 리튬 이온 배터리를 포함한 수소 경제의 연료 세포 구동 전기 자동차 및 기타 수소 경제에 대한 수소 저장으로 사용하기 위해 여러 금속 하이드 라이드가 조사되었습니다.