주요 차이 - 양극 대 캐소드
용어 음극 및 양극 편광 전기 장치의 터미널을 참조하는 데 사용됩니다. 주요 차이 양극과 음극 사이에는 일반적으로 양극이 (기존) 전류가 외부에서 장치로 흐르는 터미널이라는 것이 입니다. 캐소드 는 (기존) 전류가 장치에서 흘러 나오는 터미널입니다 . 그러나 장치가 가역적 프로세스를 겪을 때 "양극"이라고 불리는 동일한 터미널을 "캐소드"라고 할 수 있기 때문에 일부 경우에는 사용법이 엄격하게 추적되지 않습니다. 의심 할 여지없이, 이것은 혼란을 초래할 수 있으며 특정 필드의 일반적인 사용에 적응하는 것이 좋습니다. 이 기사에서는이 용어가 사용되는 몇 가지 시나리오를 살펴 보고이 장치에서 발생하는 프로세스 측면에서 사용법을 탐색합니다.
.양극이란 무엇입니까
양극은 (기존) 전류가 외부에서 장치로 흐르는 터미널입니다. 이것은 전자 을 의미합니다 장치에서 흘러 나옵니다 양극에서.
음극이란 무엇입니까
캐소드는 (기존) 전류가 장치에서 흘러 나오는 터미널입니다. 이것은 전자 을 의미합니다 이 말단으로 흐릅니다 외부에서.
갈바닉/볼타 세포
갈바니 셀의 설정은 다음과 같습니다.

갈바닉 세포
갈바니 셀에서 전극 중 하나는 다른 전극보다 더 높은 감소 전위에 있습니다. 감소 전위가 높은 전극은 전자를 얻는 능력이 더 강하므로 전자는 다른 전극으로부터 그것으로 흐릅니다. 위에서 그린 세포에서 구리는 아연보다 더 높은 감소 전위를 가지므로 아연 전극에서 전자를 끌어냅니다. 이것은 두 가지 반응과 함께 제공됩니다. 아연 전극에서 아연은 Zn 이온 및 전자로 분리됩니다. 다시 말해, 아연이 산화되고 있습니다 (전자를 잃어 버립니다)

아연으로 손실 된 전자는 전선을 가로 질러 구리 전극으로 흐릅니다. 여기서, 들어오는 전자는 큐 이온과 결합되어 구리 원자를 형성한다. 구리가 줄어들고 있습니다 (전자를 얻습니다) :

여기에서 전자는 아연 터미널에서 "장치 밖으로"흐르기 때문에 기존 전류가 장치로 흐르고 있습니다 여기. 이것은 아연 말단을 양극으로 만듭니다. 기존의 전류는 구리 터미널에서 장치 밖으로 흐르므로 구리를 캐소드로 만듭니다. 장치가 산화 환원 반응을 사용하여 작동 할 때마다 산화가 발생하는 터미널은 양극이며, 환원이 발생하는 전극은 캐소드입니다. 이것은 위의 설명에 동의합니다. 아연 (양극)은 산화되고 구리 (음극)가 줄어 듭니다.
전해 세포
전해 셀에서 전원 공급 장치는 액체 함유 이온의 전류를 생성하는 데 사용됩니다. 예를 들어, 우리는 두 개의 전극이 용융 의 샘플에 넣을 때 어떤 일이 발생하는지 살펴볼 것입니다. 염화나트륨 (NaCl 또는 일반적인 소금).
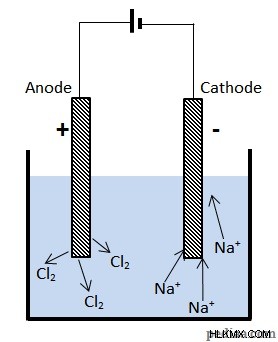
용융 염화나트륨의 전기 분해
배터리의 양극 단자에 연결된 전극이  음이온. 여기서이 이온은 전자를 꺼내 염소 가스를 형성합니다.
음이온. 여기서이 이온은 전자를 꺼내 염소 가스를 형성합니다.

음의 단자에 연결된 전극에서 양성 나트륨 이온은 전자를 얻고 나트륨 원자를 형성합니다 :

여기서, 전류를 장치로 끌어들이는 터미널은 배터리의 양수 단자에 연결된 전극입니다. 따라서 이것은 양극입니다.  이온은 여기서 전자를 잃기 때문에 산화가 아노드에서 발생한다는 생각과 일치합니다. 나트륨은 다른 전극에서 형성됩니다
이온은 여기서 전자를 잃기 때문에 산화가 아노드에서 발생한다는 생각과 일치합니다. 나트륨은 다른 전극에서 형성됩니다  이온이 줄어 듭니다. 전류 흐름 out 이 터미널에서 장치의 장치. 따라서이 말단은 음극을 형성합니다.
이온이 줄어 듭니다. 전류 흐름 out 이 터미널에서 장치의 장치. 따라서이 말단은 음극을 형성합니다.
위의 두 예는 anode 라는 것을 명확히해야합니다. 및 음극 특정 잠재력을 언급하지 않고 오히려 설정에서 전류가 흐르는 방식을 언급하지 마십시오. 예를 들어, 갈바니 셀의 "양성"전극은 "음극"이지만 전기 분해 의 경우 "양성"전극 "양극"입니다.
양극과 음극의 차이
이름 "양극"및 "캐소드"라는 이름은 외부에서 해당 터미널로 흐르는지 또는 전류가 터미널에서 외부로 흐르는지 여부에 따라 터미널에 주어질 수 있습니다. 그러나 다른 상황에서 전류가 흐르는 방식이 근본적으로 다를 수 있기 때문에,이 용어의 사용을 한 상황에서 다른 상황으로 번역하는 것은 혼란 스러울 수 있습니다. 따라서 용어를 올바르게 사용하려면 먼저 상황을 검사해야 할 수도 있습니다. 가능하면 대안이 덜 모호한 용어를 사용해야합니다 (상황에 따라 다름). 우리는 전기 화학의 두 가지 특별한 예를 논의했지만“양극”과“음극”이라는 용어는 다른 많은 분야에서도 사용됩니다. 몇 가지 예제가 아래의 요약 섹션에 언급되어 있습니다.
전류 흐름 방향 :
일반적으로 전류는 양극 로 흐릅니다 외부에서.
음극 장치에서 전류를 제공합니다. 이것은 외부 을 의미합니다 장치, 전자 양극에서 음극으로 흐릅니다.
산화 환원 반응 :
산화 환원 반응에 의존하는 장치에서는 양극에서 산화가 발생합니다.
반면 감소는 캐소드에서 발생합니다 .
갈바니 세포 및 전해 세포에서:
갈바닉 세포 및 전해 세포에서 음극 양이온을 끌어 들이고 산화됩니다.
양극 음이온을 끌어 내고 줄입니다.
전기 분해에서:
양극 양성 을 형성합니다 전기 분해의 말단
음극 음성 을 형성합니다 갈바닉 세포의 말단.
전자 건 및 X- 선 튜브에서:
전자 건 및 X- 선 튜브에서 전자를 장치로 방출하는 부품은 캐소드 을 형성합니다. .
장치 내부에서 양극 전자를 수집합니다.
정상 다이오드가 정방향 바이어스에 연결되면 양극은 p-입니다. 측면 , 이는 배터리의 양에 연결된 쪽입니다 (셀에서 전류를 그립니다). 마찬가지로 캐소드 은 n-을 형성합니다 측면 .
Zener 다이오드에서 전류가 리버스 바이어스로 흐르면 터미널의 이름을 반전시켜야하지만 p-side IS 아직도 “ 양극 이라고합니다 기술적으로 는 을 제공합니다 외부로 전류. 이것은 주목할만한 예외이며, 가능한 경우 "양극"과 "음극"이라는 용어를 피해야하는 이유를 강조합니다 (이 경우 측면을 p-이라고 지칭하는 것이 좋습니다. 측면과 n- 측면).
또 다른 혼란의 원인 " 양극 로 배터리 ". 배터리가 방전되면 용어가 작동합니다. 그러나 배터리가 충전 될 때 기술적으로 용어를 반전시켜야합니다.
참고 문헌 :
Denker, J. (2004). 양극 및 음극을 정의하는 방법 . 2015 년 10 월 1 일에 welcome에서 av8n.com
까지 검색했습니다






