주요 차이 - 분자간 대 분자 내 힘
분자간 및 분자 내 힘은 개별 분자와 원자를 함께 보유하는 두 가지 유형의 힘입니다. 이 힘은 분자와 원자의 움직임을 제어합니다. 두 유형의 힘은 물질의 화학적 및 물리적 특성을 결정합니다. 주요 차이 분자간과 분자 내 힘 사이에서 분자간 력이 분자 자체 사이에 존재하는 반면 분자 내 힘은 분자 내의 원자 사이에 존재한다는 것입니다. 또한이 힘 사이에는 더 많은 차이가 있습니다.
이 기사에서
를 검사합니다 1. 분자간 힘은 무엇입니까?
- 정의, 특징, 특성
2. 분자 내 힘이란 무엇입니까?
- 정의, 특징, 특성
3. 분자간과 분자 내 힘의 차이점은 무엇입니까?

분자간 력이란 무엇입니까
분자간 힘은 양성 및 음전하로 인해 물질에 개별 분자를 결합시키는 힘입니다. 분자간 힘은 매력적인 힘이지만 화학적 결합은 아닙니다. 따라서, 분자간 힘은 분자 내 힘보다 훨씬 약하다. 이 힘은 물질의 물리적 특성을 결정합니다. 가장 중요한 물리적 특성 중 하나는 물질의 상태를 고체, 액체 또는 가스인지 결정하는 능력입니다. 이 힘은 가스의 무작위 운동과 액체와 고체가 액체와 고체 분자를 함께 유지함에 따라 액체와 고체의 존재를 담당합니다. 따라서, 분자간 힘은 물질의 용융 및 끓는점을 결정한다. 용융 또는 끓는점은 분자간 힘의 강도에 비례합니다. 즉, 용융 또는 비등점이 높을수록 분자간 힘이 강해집니다. 주어진 온도에서 가스, 액체 및 고체의 분자간 힘의 강도는 다음과 같습니다.
가스 <액체 <고체
쌍극자 쌍극자 힘, 런던 분산 힘 및 수소 결합력으로 알려진 세 가지 유형의 분자간 힘이 있습니다. 이러한 모든 결합은 분자에서 전자 및 핵의 배열로 인한 전하로 인해 발생합니다. 세 가지 유형 중에서, 수소 결합은 가장 강력한 형태의 분자간 결합입니다. 물 분자는 분자의 특정 위치에서 부분 전하가 존재하기 때문에 수소 결합에 의해 보류됩니다.
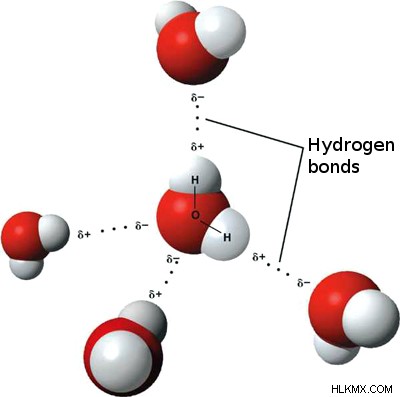
분자 내 힘은 무엇입니까
분자에 원자를 고정하는 힘을 분자 내 힘이라고합니다. 이 힘은 화학 결합의 형성을 담당합니다. 따라서, 분자 내 힘은 분자간 힘보다 훨씬 강하다. 분자 내 상호 작용은 두 원자가 전자를 공유하거나 다른 원자로/전자를 기증/게인 할 때 발생합니다. 두 원자 사이에서 전자가 공유 될 때, 결합을 공유 결합이라고합니다. 하나의 원자가 전자를 제공/ 게인하면 결합을 이온 결합이라고합니다. 분자 내 힘은 물질의 화학적 파라미터를 결정합니다. 금속 결합은 또한 분자 내 힘의 유형으로 분류됩니다.
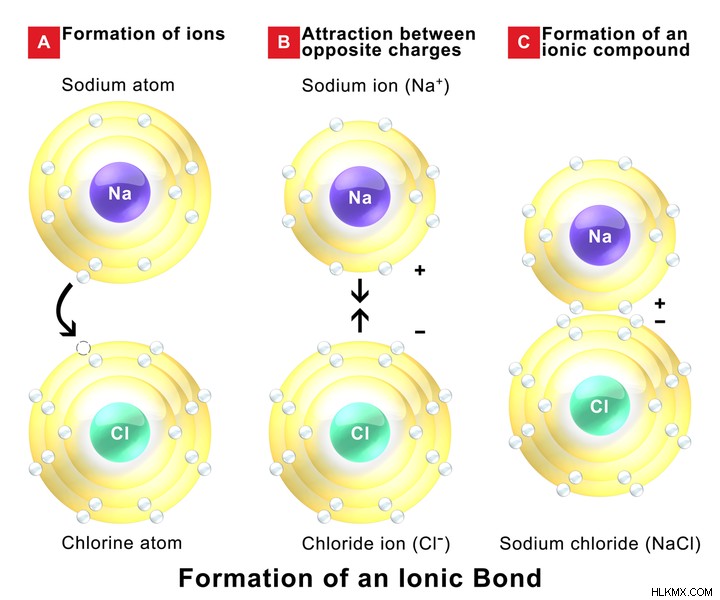
분자간과 분자 내 힘의 차이
정의
분자간 힘 물질에 분자를 붙잡는 힘입니다.
분자 내 힘 분자에서 원자를 고정시키는 힘입니다.
강도
분자간 힘 분자 내 힘보다 약합니다.
분자 내 힘 분자간 힘보다 강합니다.
특성 결정
분자 력 물질 상태 (고체/액체/가스) 및 용융/끓는점 등과 같은 물리적 특성을 결정하십시오.
분자 내 힘 물질의 화학적 거동을 결정하십시오.
힘의 본질
분자간 힘 매력적인 힘입니다.
분자 내 힘 화학적 결합입니다.
예제
분자 력 쌍극자 쌍극자 힘, 런던 분산 세력 및 수소 결합력으로 분류됩니다.
분자 내 힘 공유, 이온 및 금속 결합으로 분류됩니다.