주요 차이 - 1 차 대 2 차 세포
배터리는 전기를 생성 할 수있는 셀입니다. 배터리는 하나 이상의 전기 화학 셀을 가질 수 있으며 전원 공급 장치와 함께 작동하는 외부 장치와 연결될 수있는 터미널로 구성됩니다. 1 차 세포와 2 차 세포는 두 가지 유형의 배터리입니다. 1 차 세포와 2 차 세포의 주요 차이점은 1 차 세포가 한 번만 사용할 수 있다는 것입니다 2 차 세포는 두 번 이상 사용될 수 있습니다.
주요 영역을 다루었습니다
1. 1 차 세포는 무엇입니까
- 정의, 구조, 화학 반응
2. 2 차 세포
- 정의, 구조, 화학 반응
3. 1 차 세포와 2 차 세포의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :배터리, 1 차 셀, 2 차 셀, 양극, 음극, 전기 
1 차 셀이란 무엇입니까?
1 차 셀 또는 1 차 배터리는 비 응원 배터리라고도합니다 . 이 배터리는 주로 배터리가 소진 될 때 다시 충전 할 수 없기 때문입니다. 재사용 할 수는 없지만, 1 차 셀은 자체 전하 속도가 비교적 낮기 때문에 장기 활용을위한 전력을 저장하는 데 매우 유용합니다. 따라서, 그들의 사용은 심장 환자, 스마트 미터 및 청구가 실용적이지 않은 군사 캠페인의 서비스 맥박 조정기에서 관찰 될 수 있습니다
1 차 셀은 배터리 내부에서 발생하는 화학 반응으로 인해 반응 할 수 없습니다. 화학 반응은 세포에 존재하는 모든 화학 물질을 사용하고 모든 화학 종이 사용되면 발전이 종료됩니다.
1 차 배터리 또는 1 차 셀은 양극 (양으로 하전 된 끝)과 음극 (음의 하전 끝)으로 구성됩니다. 흑연은 일반적으로 음극으로 사용되며 아연은 양극으로 사용됩니다. 산화 반응은 전자가 회로에 기증되는 양극에서 발생하고 전자가 외부에서 수용되는 음극에서 환원 반응이 발생합니다. 전류를 통과하는 데 도움이되는 전해질도 있습니다. 전해질은 음극과 양극 사이에서 전하를 전하 할 수있는 전기 하전 된 이온으로 구성됩니다.
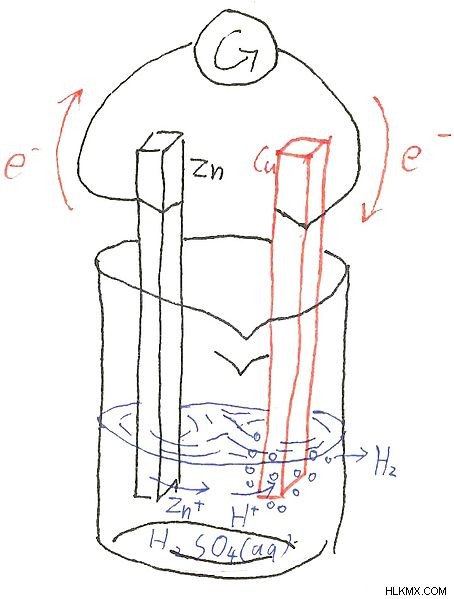
그림 1 :아연 양극과 CU 캐소드가있는 1 차 배터리
기본 셀의 일반적인 예는 leclanche 셀 입니다. . 아연 양극과 다공성 흑연 캐소드로 구성됩니다. 배터리 내부에 존재하는 전해질은 NH 4 의 촉촉한 혼합물입니다. Cl (염화 암모늄), 아연 염화 아연 (Zncl 2 ) 및 망간 이산화물 (mno 2 ). 세포 내부에서 발생하는 화학적 반응은 다음과 같이 주어질 수 있습니다.
anode :zn (s) → zn (aq) +2e
캐소드 :2nh 4 (aq) +2e → 2nh 3 (g) +h 2 (g)
두 가스 nh 3 및 H 2 음극에서 생산됩니다. 그러나이 가스는 다시 아래와 같이 반응에 참여할 것입니다.
2nh 3 (g) + zn (aq) → [zn (nh 3 )
2mno 2 (s) + h 2 (g) → mn 2 o 3 (s) +h 2 o (l)
2 차 세포는 무엇입니까?
2 차 셀은 2 차 배터리 또는 충전식 배터리로도 알려져 있습니다 . 이 배터리는 작동을 중단 할 때 충전 할 수 있으므로 여러 번 사용할 수 있습니다. 이 배터리에서 발생하는 화학 반응은 가역적입니다. 이는 전하를 적용하여 이러한 반응을 되돌릴 수 있음을 의미합니다. 그러나 1 차 배터리와 달리 사용하기 전에 2 차 배터리를 충전해야합니다. 충전기는 재충전 과정에 사용됩니다.
다른 2 차 배터리는 다른 기능을 제공합니다. 따라서 사용자는 특정 요구에 따라 어떤 유형의 배터리를 사용해야하는지 알아야합니다.
이 배터리에는 기본 배터리와 동일한 캐소드와 양극이 있습니다. 환원 반응은 음극에서 발생하는 반면 산화 반응은 양극에서 발생합니다. 보조 세포의 좋은 예는 납 저장/산 배터리입니다. 그 셀 내부에서 발생하는 반응은 아래에 나와 있습니다.
캐소드 :pbo 2 (s) +hso 4 (aq) +3H (aq) +2E → PBSO 4 (s) +h 2 o (l)
양극 :pb (s) +hso 4 (aq) → pbso 4 (s) +h (aq) +2e

그림 2 :납 산 배터리의 개략도.
1 차 세포와 2 차 세포 간의 차이
정의
1 차 세포 : 1 차 셀은 재충전되거나 재사용 할 수없는 배터리입니다.
2 차 세포 : 보조 셀은 재충전 및 재사용 할 수있는 배터리입니다.
화학 반응
1 차 세포 : 1 차 세포에서는 돌이킬 수없는 반응이 발생합니다.
2 차 세포 : 이차 세포에서는 가역적 반응이 발생합니다.
사용량
1 차 세포 : 1 차 셀은 한 번만 사용할 수 있습니다.
2 차 세포 : 이차 세포는 두 번 이상 사용될 수 있습니다.
중요성
1 차 세포 : 1 차 세포는 즉시 전류를 생성 할 수 있습니다. 따라서 휴대용 장치에 사용됩니다.
2 차 세포 : 2 차 셀은 사용하기 전에 충전해야합니다. 그래서 그들은 자동차에서 사용할 수 있습니다.
자체 전하율
1 차 세포 : 1 차 셀은자가 차지 속도가 낮고 장기 전력 저장에 사용될 수 있습니다.
2 차 세포 : 2 차 세포는 1 차 세포에 비해 더 높은 자기 전하 속도를 갖는다.
결론
배터리는 기술 응용 분야에서 매우 중요합니다. 모든 배터리는 전기 화학 세포로 만들어집니다. 1 차 및 2 차 셀은 일상 생활에서 유용한 두 가지 유형의 배터리입니다. 1 차 세포와 2 차 세포의 주요 차이점은 1 차 세포가 한 번만 사용할 수 있지만 2 차 세포는 두 번 이상 사용할 수 있다는 것입니다.