주요 차이 - 결합 에너지 대 본드 해리 에너지
결합 에너지 및 본드 해리 에너지는 두 원자 사이의 화학적 결합의 분해와 관련이 있기 때문에 종종 혼란스러워 보이는 용어입니다. 결합 에너지 및 결합 분리 에너지의 개념은 일반적으로 공유 결합과 관련하여 사용됩니다. 이온 결합과 달리 공유 결합은 전자의 공유로 인해 형성된 원자 사이의 직접적인 연결이기 때문입니다. 결합 에너지와 결합 해리 에너지의 주요 차이점은 결합 에너지가 화합물에서 동일한 두 가지 유형의 원자 사이의 모든 결합을 분해하는 데 필요한 평균 에너지의 양을 의미한다는 것입니다 본드 해리 에너지는 호모 분해에서 특정 결합을 분해하는 데 필요한 에너지의 양입니다 . 다시 말해, 결합 에너지는 동일한 유형의 원자 사이에 존재하는 모든 결합의 결합 분리 에너지의 평균입니다.
주요 영역을 다루었습니다
1. 본드 에너지 란 무엇입니까
- 정의, 계산 단위, 예
2. 본드 해리 에너지
- 정의, 예
3. 결합 에너지와 본드 해리 에너지의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :결합 에너지, 해리 에너지, 화학적 결합, 원자, 동종, 자유 방사선

결합 에너지
결합 에너지는 화합물의 동일한 두 유형의 원자 사이에 존재하는 모든 결합을 분해하는 데 필요한 평균 에너지 양으로 정의됩니다. 일반적으로, 원자는 에너지를 줄이고 에너지 수준을 낮추기 위해 서로 결합합니다. 이렇게하면 원자가 안정적이됩니다. 결합이 발생하면 일정량의 에너지가 방출됩니다. 이 에너지는 종종 열로 방출됩니다. 그러므로 채권을 깨기 위해 어느 정도의 에너지가 주어져야합니다.
본드 에너지가 계산 된 단위는 kjmol입니다. 결합 에너지는 동일한 원자 사이에 1, 2 또는 3 개의 결합을 갖는 분자에 대해 다릅니다. 예를 들어, C-C 단일 결합은 해당 결합을 파괴하기 위해 347 kjmol 결합 에너지를 필요로하는 반면 C =C 이중 결합은 614 kjmol을 필요로합니다. 그러나 C =C에 필요한 에너지의 양은 C-C 단일 결합의 이중 값이 아닙니다. 따라서 결합 에너지는 하나의 결합 유형과 다른 결합 유형으로 다릅니다.
결합 에너지와 본드 해리 에너지의 차이를 고려할 때 고려할 수있는 가장 좋은 예는 물입니다 (h 2 o) 분자.
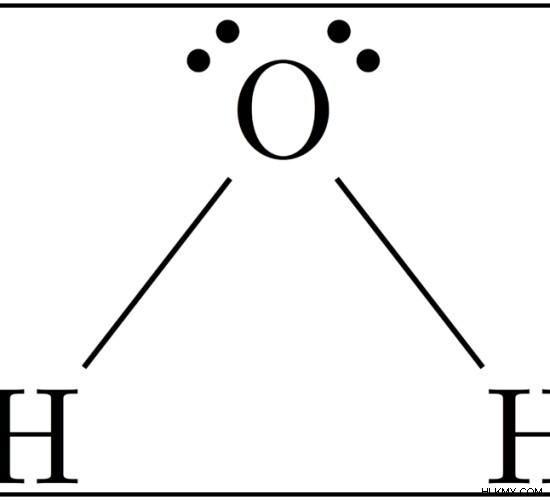
그림 :H2O의 구조
h 2 o 분자는 H-O-H로 결합 된 2 개의 O-H 결합으로 구성된다. H 2 에 대한 결합 에너지 O는 H 2 의 2 개의 O-H 결합을 파괴하는 데 필요한 에너지의 평균입니다. o 분자. 두 개의 결합은 동일하지만, 첫 번째 O-H 결합이 H-OH 구조로부터 파손되고 두 번째 결합은 O-H로 분해되기 때문에 에너지 값은 약간 다릅니다. 산소 원자는 수소 원자보다 전기 음성이기 때문에, 물 분자로부터의 O-H 결합은 산소 원자의 양쪽에 수소 원자의 존재 또는 부재에 의해 영향을 받는다. 따라서 평균은 결합 에너지로 간주됩니다.
본드 해리 에너지
본드 해리 에너지는 동종 분해에서 특정 결합을 분해하는 데 필요한 에너지의 양으로 정의 될 수 있습니다. 화학 결합의 강도를 측정합니다. 결합 분리 에너지는 또한 공유 결합과 관련이 있습니다. 전자가 원자 사이에 공유 될 때 공유 결합이 형성되기 때문에, 공유 전자는 결합 해리 공정에서 원자에 의해 다시 취해진다. 따라서, 형성된 라디칼은 짝을 이루지 않은 전자를 갖기 때문에 매우 반응성이다. 따라서, 동종 분해 절단이 발생한다.
동일한 예제 h 2 O는 여기서 촬영되며, H 2 의 결합 분리 o 분자는 아래와 같이 동종 분열에 의해 OH 라디칼과 H 라디칼을 형성 할 것이다.
h 2 O +에너지 → OH +H
따라서 본드 해리 에너지에 의해 실제로 주어진 것은 –o-h의 하나의 결합을 깨는 데 필요한 에너지입니다. 따라서 두 –o-h 결합에 대해 동일한 값이 제공됩니다.
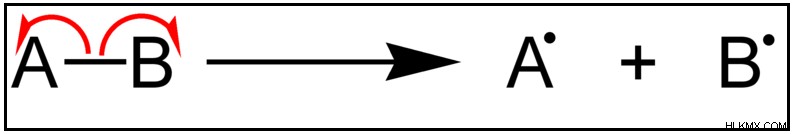
그림 2 :화학 결합의 동종 분해
결합 에너지와 본드 해리 에너지의 차이
정의
채권 에너지 : 결합 에너지는 화합물의 동일한 두 유형의 원자 사이에 존재하는 모든 결합을 분해하는 데 필요한 평균 에너지량을 말합니다.
본드 해리 에너지 : 본드 해리 에너지는 동종 분해에서 특정 결합을 분해하는 데 필요한 에너지의 양입니다.
제품
채권 에너지 :b Ond Energy는 결합 형성의 출발 물질 인 원자를 형성하는 데 필요한 에너지를 제공합니다.
본드 해리 에너지 : 본드 해리 에너지는 그 특정 결합을 형성하는 원자에서 자유 라디칼을 형성하는 데 필요한 에너지를 제공합니다.
에너지 값
채권 에너지 : 값은 한 채권과 다른 채권으로 다를 것입니다.
본드 해리 에너지 : 값은 각 채권에 대해 동일합니다.
결론
결합 에너지와 본드 해리 에너지는 특정 화합물의 형성 또는 파괴에 필요한 에너지를 계산하는 데 중요합니다. 채권 에너지와 본드 해리 에너지는 개요에 의해 동일하게 보이지만 두 가지 형태입니다. 결합 에너지와 결합 해리 에너지의 주요 차이점은 결합 에너지가 화합물의 동일한 두 유형의 원자 사이의 모든 결합을 분해하는 데 필요한 평균 에너지의 양이라는 반면 결합 해리 에너지는 호모 분해에서 특정 결합을 분해하는 데 필요한 에너지의 양입니다. 다시 말해, 결합 에너지는 동일한 유형의 원자 사이에 존재하는 모든 결합의 결합 분리 에너지의 평균입니다.
참조 :
1. " 유기 분자의 결합 분리 에너지.” 화학 libretexts. LibreTexts, 2016 년 7 월 21 일. 웹. 여기에서 사용할 수 있습니다. 2017 년 6 월 13 일.
이미지 제공 :
1. Commons Wikimedia를 통한 Jürgen Martens (Public Domain)의 "Homolysis (Chemistry)"의 "H2O Lewis Structured Png"-Commons Wikimedia
2. "Homolysis (Chemistry)"