주요 차이 - 알칸 대 알켄
탄화수소는 c와 h 원자로 구성된 화합물입니다. 이들 탄화수소 분자는 C와 H 원자의 상이한 조합을 가지며 분자의 공간 배열에 따라 상이한 형상을 갖는다. 지금까지 수천 개의 탄화수소가 발견되었으므로, 이들 화합물에 대해 다른 분류가있다. 알칸과 알켄은 두 가지 범주입니다. 이러한 유형의 탄화수소는 분지, 브랜치 및 주기적 탄화수소로 구성됩니다. 알칸과 알켄의 주요 차이점은 알칸은 포화 탄화수소이고 알켄은 불포화 탄화수소라는 것입니다.
주요 영역을 다루었습니다
1. Alkanes는 무엇입니까
- 정의, 명명법, 특성 및 반응
2. Alkenes는 무엇입니까
- 정의, 명명법, 특성 및 반응
3. Alkanes와 Alkenes의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. Alkanes와 Alkenes의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :지방족, 알칸, 알켄, 분지 알칸, 원유, 주기적 알칸, 탄화수소, 선형 알칸, 천연 가스, 포화 탄화수소, 불포화 탄화수소 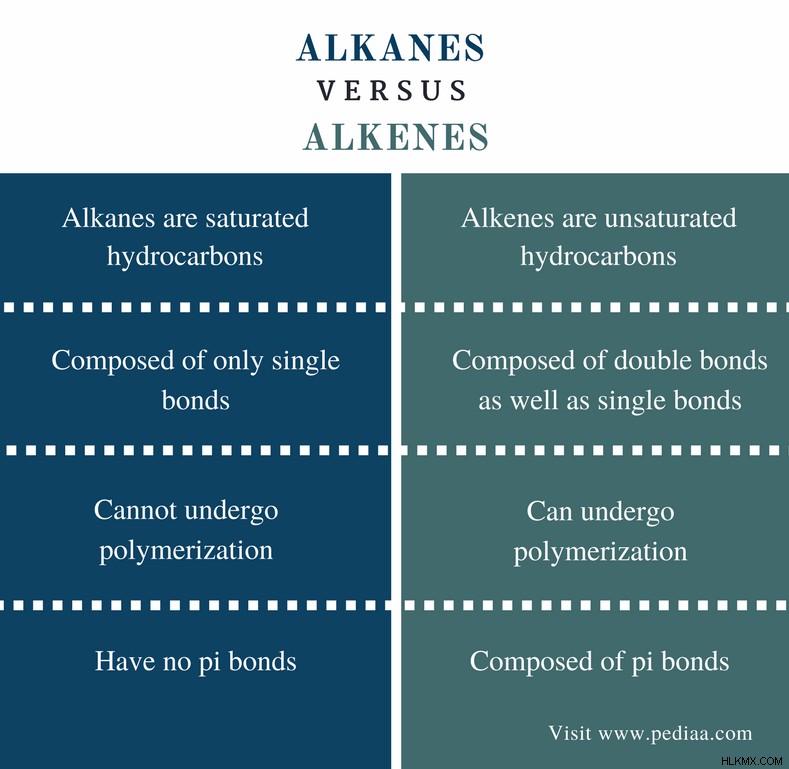
alkanes
알칸은 화학식 c n 를 갖는 포화 탄화수소입니다. H 2n+2 (여기서 n은 정수입니다). 알칸은 C 및 H 원자로 구성되기 때문에 탄화수소라고합니다. 이 모든 원자는 단일 공유 결합을 통해 서로 연결됩니다. 이중 또는 삼중 결합이 없기 때문에 알칸은 포화 탄화수소라고합니다.
알칸은 광범위한 유기 분자 그룹입니다. 그것들은 탄소 원자의 수와 그들이 포함 된 측면 그룹에 따라 명명됩니다. 가장 작은 알칸은 메탄입니다. 메탄에서, 중심 탄소 원자는 4 개의 수소 원자에 결합된다. 알칸의 IUPAC 명명법은 그리스 접두사를 기반으로합니다. 일부 예는 아래 표에 나와 있습니다.
|
화학식
|
분자의 탄소 원자
|
그리스 접두사 사용
|
알칸의 이름
|
|
ch 4
|
1
|
메트-
|
메탄
|
|
c 2 H 6
|
2
|
ETH-
|
에탄
|
|
c 3 H 8
|
3
|
소품-
|
프로판
|
|
c 4 H 10
|
4
|
그러나-
|
부탄
|
|
c 5 H 12
|
5
|
펜-
|
펜탄
|
알칸의 구조에 따르면, 세 가지 주요 유형의 알칸이 있습니다. 그들은;
입니다
선형 알칸 알칸 분자에 부착 된 측면 그룹이없는 직선 체인 알칸이다. 분지 알칸 알킬 그룹을 측면 그룹으로서의 분자이지만, 포화 분자이다. 알킬기는 하나의 수소 원자가 결여 된 알칸이며, 따라서 탄소 원자에 부착 될 수있는 빈 지점을 갖는다. Cyclic alkanes 링 구조입니다.
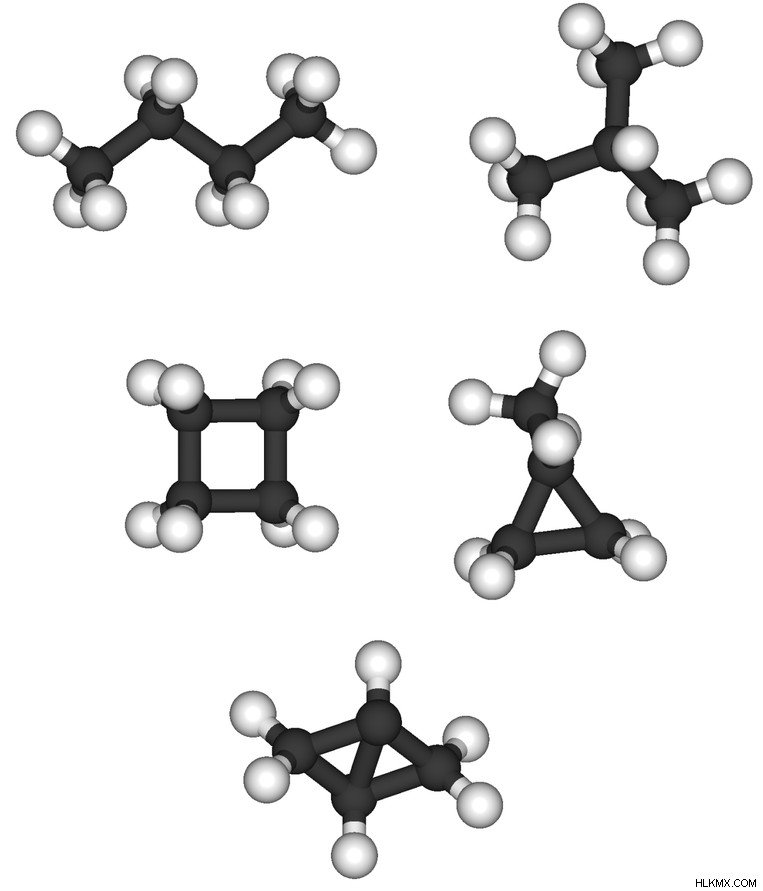
그림 1 :다른 형태의 알칸스
알칸의 주요 원천은 원유와 천연 가스입니다. 이 연료는 주로 알칸 분자로 구성됩니다. 따라서 우리는 석유 정제를 통해 알칸을 얻을 수 있습니다. 분수 증류라고 불리는 프로세스는이 알칸을 분리합니다.
모든 알칸은 무색이며 무취입니다. 탄소 원자의 수가 증가함에 따라 용융점 및 비등점은 증가합니다. 표준 온도 및 압력 조건 하에서 일부 알칸은 액체이고 일부는 기체 화합물입니다. 이 차이는 끓는점이 다르기 때문입니다. 알칸은 이성질체를 나타냅니다. 알칸 분자는 분자의 구조 및 공간 배열에 따라 구조적 이성질체 또는 입체 소성을 가질 수있다.
알칸이 겪는 주요 반응 중 하나는 연소 반응입니다. 알칸의 연소는 알칸과 분자 산소 사이의 반응을 포함한다. 이 반응은 이산화탄소, 물 및 열을 생성합니다. 또한, 알칸은 할로겐화 반응을 겪을 수있다. 거기에서, cl 2 와 같은 분자 충분한 에너지가 제공 될 때 알칸과 반응하십시오. 이 반응은 알킬 할라이드를 생성합니다.
alkenes
Alkenes는 화학적 공식을 갖는 불포화 탄화수소 c n 입니다. H 2n . 알켄은 C와 H 원자로 만 구성되기 때문에 탄화수소라고합니다. 그것들은 적어도 하나의 c =c 이중 결합으로 구성되어 있기 때문에 불포화라고합니다. 따라서, 하나의 탄소 원자 만있는 알켄은 없을 수 없다. 가장 간단한 알켄은 c 2 입니다 H 4 . 작은 알켄은 실온에서 가스입니다. 다른 알켄은 액체입니다. 그러나 매우 많은 수의 탄소 원자가있는 알켄은 밀랍 고체 상태에 있습니다.
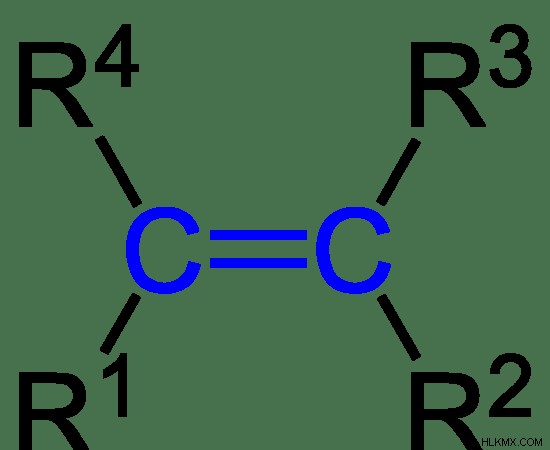
그림 2 :알켄의 일반적인 구조
위의 이미지에서 R1, R2, R3 및 R4는 서로 동일하거나 서로 다를 수있는 알킬 그룹입니다.
알켄은 하나 이상의 이중 결합을 가질 수 있습니다. 대부분의 경우, 이러한 이중 결합은 대안적인 방식으로 배열됩니다. 알켄은 무색이며 비극성입니다. 알켄은 이중 결합의 존재로 인해 반응성 분자로 간주됩니다. 이 이중 결합은 시그마 본드와 PI 결합으로 구성됩니다. 이 Pi 결합은 분해 될 수 있습니다. 이것을 이중 채권의 개방이라고합니다. 이어서 전기성은 이중 결합으로 이들 탄소 원자에 부착 될 수있다. 이것을 알켄의 첨가 반응이라고합니다.
또한 중합은 알켄이 겪을 수있는 주요 반응입니다. 이중 결합의 개방은 알켄이 중합을 겪을 수있게한다. 여기서는 하나의 알켄 분자를 단량체라고합니다. 이것은 매우 중요한 폴리머의 생산으로 이어진다.
alkenes는 기하학적 이성질체를 보여줍니다. 이것을 시스 트랜스 이성질체라고도합니다. 알켄을 지명 할 때,이 분자의 시스-트랜스 형상도 고려해야한다.
알칸과 알켄 간의 유사성
- 알칸과 알켄은 탄화수소입니다.
- 작은 알칸 분자와 작은 알켄 분자는 실온에서 가스입니다.
- 알칸과 알켄의 원자는 공유 결합을 통해 서로 결합됩니다.
- 둘 다 비극성 분자입니다.
- 그러므로 둘 다 물과 다른 극지 용매에 불용성이 있습니다.
- 알칸과 알켄은 모두 이산화탄소 및 수증기와 함께 열을 형성하기 위해 태워 질 수 있습니다.
알칸과 알켄의 차이
정의
알칸 : 알칸은 화학적 공식을 갖는 포화 탄화수소입니다. c n H 2n+2.
알켄 : 알켄은 화학적 공식 C n 를 갖는 불포화 탄화수소이다 H 2n .
화학적 결합
알칸 : 알칸은 단일 결합 만 구성됩니다.
알켄 : 알켄은 단일 채권뿐만 아니라 이중 채권으로 구성됩니다.
화학식
알칸 : 알칸의 화학적 공식은 c n 입니다 H 2n+2 .
알켄 : 알켄의 화학적 공식은 c n 입니다 H 2n .
중합
알칸 : 알칸은 중합을 겪을 수 없습니다.
알켄 : 알켄은 중합을 겪을 수 있습니다.
PI 본드
알칸 : 알칸에는 PI 결합이 없습니다.
알켄 : 알켄은 PI 결합으로 구성됩니다.
결론
알칸과 알켄은 중요한 탄화수소입니다. 알칸과 알켄 사이에는 비극성 거동과 물의 파산성과 같은 유사점이 있지만, 많은 특징이 있습니다. 알칸과 알켄의 주요 차이점은 알칸이 포화 탄화수소이고 알켄은 불포화 탄화수소라는 것입니다.