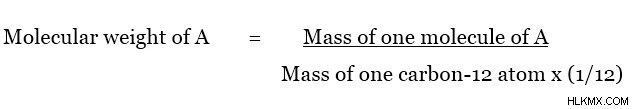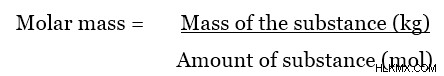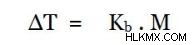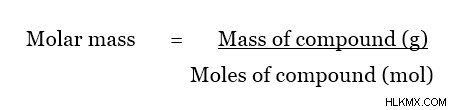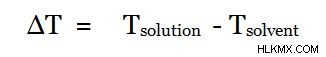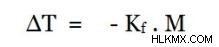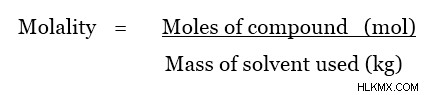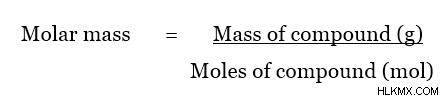어금니 질량은 물질의 중요한 물리적 특성입니다. 밀도, 융점, 끓는점 및 시스템에서 다른 물질과 반응하는 물질의 양과 같은 다른 물리적 및 화학적 특성을 분석, 비교 및 예측하는 데 매우 유용합니다. 이 기사에서는 5 가지 방법에 대해 논의 할 것입니다. 원자 질량, 방정식, 끓는점 상승, 동결 지점 우울증 및 삼투압을 사용하여 몰 질량을 계산합니다.
주요 영역이 적용됩니다
1. 어금니 질량
- 정의, 계산 방정식, 설명
2. 어금니 질량을 찾는 방법
- 예제로 어금니 질량을 계산하는 몇 가지 방법
3. 물질의 어금니 질량을 아는 것이 중요한 이유
- 어금니 질량의 적용
핵심 용어 :Avogadro의 숫자, 끓는점 높이, Calusius-clapeyron, cryoscopic 상수, ebullioscopic constant, freezing point 우울증, 몰 질량, 분자량, 삼투압, 상대적 원자 질량

어금니 질량
어금니 질량은 특정 물질의 두더지의 질량입니다. 물질의 어금니 질량에 가장 일반적으로 사용되는 단위는 GMOL입니다. 그러나, 몰 질량에 대한 SI 단위는 kgmol (또는 kg/mol)이다. 어금니 질량은 다음 방정식을 사용하여 계산할 수 있습니다.
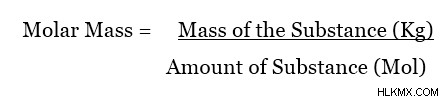
두더지 또는 mol은 물질의 양을 측정하는 데 사용되는 단위입니다. 물질의 한 몰은 물질이 만들어지는 매우 많은 수, 6.023 x 10의 원자 (또는 분자)와 같습니다. 이 숫자를 avogadro의 숫자 이라고합니다 . 원자의 유형이 무엇이든, 그것의 한 몰은 그 양의 원자 (또는 분자)와 같기 때문에 일정합니다. 따라서, 몰 질량은 새로운 정의, 즉 몰 질량은 특정 물질의 총 질량 (또는 분자)의 총 질량이다. 혼란을 피하려면 다음 예를 살펴보십시오.
- 화합물 A는 분자로 구성됩니다.
- 화합물 B는 B 분자로 구성됩니다.
- 한 두더지의 화합물 A는 분자의 6.023 x 10으로 구성됩니다.
- 1 몰의 화합물 B는 6.023 x 10의 B 분자로 구성됩니다.
- 화합물 A의 몰 질량 A는 6.023 x 10의 질량의 합입니다.
- 화합물 B의 몰 질량 B.
이제 우리는 이것을 실제 물질에 적용 할 수 있습니다. h 2 의 1 몰 O는 6.023 x 10 h 2 로 구성됩니다 o 분자. 총 질량은 6.023 x 10 h 2 입니다 o 분자는 약 18 g이다. 따라서, H 2 의 몰 질량 O는 18 g/mol입니다.
어금니 질량을 찾는 방법
물질의 몰 질량은 몇 가지 방법을 사용하여 계산할 수 있습니다.
- 방법 1 :원자 질량을 사용하여 어금니 질량 계산
- 방법 2 :방정식을 사용하여 어금니 질량 계산
- 방법 3 :끓는점 고도에서 어금니 질량을 계산
- 방법 4 :동결 지점 우울증에서 어금니 질량 계산
- 방법 5 :삼투압에서 어금니 질량 계산
이 방법은 아래에서 자세히 설명합니다.
1. 원자 질량을 사용하여 어금니 질량을 찾는 방법
분자의 몰 질량은 원자 질량을 사용하여 결정될 수 있습니다. 이것은 존재하는 각 원자의 어금니 질량을 첨가하여 수행 할 수 있습니다. 요소의 어금니 질량은 다음과 같습니다.
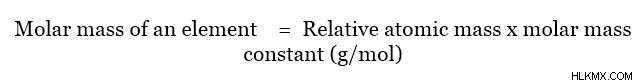
상대 원자 질량은 카본 -12 원자의 질량에 비해 원자의 질량이며 단위가 없습니다. 이 관계는 다음과 같이 주어질 수 있습니다.
이 기술을 이해하려면 다음 예를 고려해 봅시다. 다음은 동일한 원자를 가진 화합물, 여러 다른 원자의 조합 및 다수의 원자의 조합에 대한 계산입니다.
계산의 예
1. h 2의 몰 질량 계산 및 HCL
3. c 6 의 몰 질량 H 12 o 6
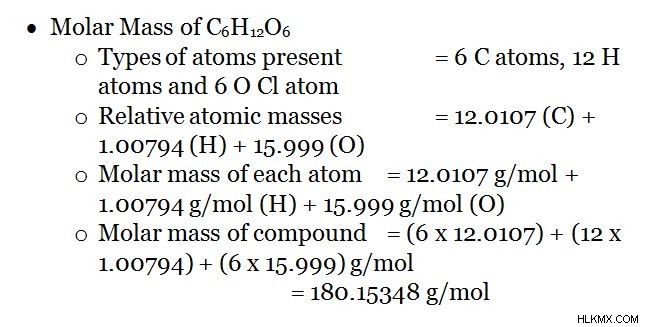
2. 방정식을 사용하여 어금니 질량을 찾는 방법
몰 질량은 아래에 주어진 방정식을 사용하여 계산할 수 있습니다. 이 방정식은 알려지지 않은 화합물을 결정하는 데 사용됩니다.
계산의 예
다음 예를 들어보십시오.
화합물 D는 용액에있다. 세부 사항은 다음과 같이 제공됩니다.
- 화합물 D는 강력한 기초입니다.
- 분자 당 하나의 이온을 방출 할 수 있습니다.
- 화합물 D의 용액은 0.599g의 화합물 D를 사용하여 만들어졌다.
- 1 :1 의 비율로 HCL과 반응합니다.
그러면 결정은 산베이스 적정에 의해 수행 될 수 있습니다. 그것은 강한 염기이기 때문에 페놀프탈레인 지표의 존재하에 강산 (예 :HCl, 1.0 mol/L)으로 용액을 적정하십시오. 색상 변화는 적정의 종말점 (예 :15.00ml의 HCL이 첨가 될 때)을 나타내며, 이제 알려지지 않은 염기의 모든 분자는 첨가 된 산으로 적정합니다. 그런 다음 미지의 화합물의 몰 질량은 다음과 같이 결정될 수 있습니다.
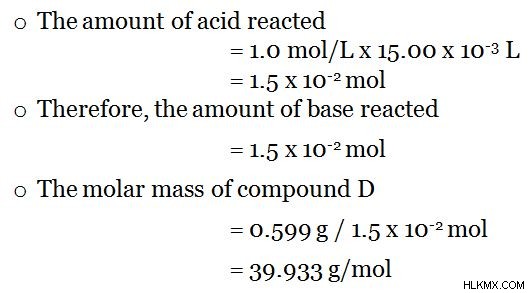
3. 끓는점 고도에서 어금니 질량을 찾는 방법
끓는점 고도는 순수한 용매에 화합물을 첨가하면 순수한 용매의 것보다 그 혼합물의 끓는점을 더 높은 끓는점으로 증가시킬 것이라고 설명하는 현상입니다. 따라서, 첨가 된 화합물의 몰 질량은 두 끓는점 사이의 온도 차이를 사용하여 발견 될 수있다. 순수한 용매의 끓는점이 t 용매 인 경우 용액의 끓는점 (첨가 된 화합물 포함)은 t 용액 입니다. , 두 끓는점의 차이는 다음과 같이 주어질 수 있습니다.
clausius-clapeyron 관계 그리고 Raoult의 법칙에 따르면, 우리는 용액의 ΔT와 molality as,
의 관계를 얻을 수 있습니다.여기서, k b ebullioscopic 상수, 이는 용매의 특성에만 의존하고 M은 몰입니다.
위의 방정식에서, 우리는 용액의 몰 리이트에 대한 값을 얻을 수 있습니다. 이 용액의 제조에 사용 된 용매의 양이 알려져 있으므로 첨가 된 화합물의 두더지 값을 찾을 수 있습니다.
이제 우리는 용액의 화합물의 두더지와 추가 된 화합물의 질량을 알기 때문에 방정식을 사용하여 화합물의 몰 질량을 결정할 수 있습니다.
4. 동결 지점 우울증에서 어금니 질량을 찾는 방법
동결 지점 우울증은 끓는점 높이와 반대입니다. 때때로, 화합물이 용매에 첨가 될 때, 용액의 동결점은 순수한 용매의 것보다 낮아진다. 위의 방정식은 약간 수정되었습니다.
Δt 값은 비등점이 초기 값보다 낮기 때문에 값 마이너스 값입니다. 용액의 몰은 비등점 상승 방법과 같은 방식으로 얻을 수 있습니다.
여기, k f cryoscopic constant 로 알려져 있습니다 . 그것은 용매의 특성에만 의존합니다.
나머지 계산은 끓는점 고도 방법과 동일합니다. 여기에서 첨가 된 화합물의 두더지는 아래 방정식을 사용하여 계산할 수 있습니다.
그러면 어금니 질량은 첨가 된 화합물의 값과 화합물의 질량을 사용하여 계산할 수 있습니다.
5. 삼투압에서 어금니 질량을 찾는 방법
삼투압은 삼투에 의해 순수한 용매가 주어진 솔루션으로 통과하는 것을 피하기 위해 적용 해야하는 압력입니다. 삼투압은 다음 방정식으로 주어질 수 있습니다.
π =mrt
π가 삼투압 일 때
M은 용액의 몰토리성이다
r은 범용 가스 상수입니다
t는 온도
입니다솔루션의 어금니는 다음 방정식에 의해 주어진다.
솔루션의 볼륨을 측정 할 수 있고 어금니는 위와 같이 계산 될 수 있습니다. 따라서, 용액 내 화합물의 두더지를 측정 할 수있다. 그런 다음 몰 질량은 방정식
를 사용하여 결정될 수 있습니다.물질의 어금니 질량을 아는 것이 왜 중요한가
- 다른 화합물의 어금니 질량은 해당 화합물의 용융점과 끓는점을 비교하는 데 사용될 수 있습니다.
- 어금니 질량은 화합물에 존재하는 원자의 질량 백분율을 결정하는 데 사용됩니다.
- 어금니 질량은 화학 반응에서 매우 중요합니다.
- 실험 설정이 설계되기 전에 어금니 질량을 아는 것은 매우 중요합니다.
요약
주어진 화합물의 몰 질량을 계산하는 몇 가지 방법이 있습니다. 그들 중에서 가장 쉬운 방법은 해당 화합물에 존재하는 어금니 질량을 첨가하는 것입니다.