주요 차이 - 친 핵성 대 전자 성 치환 반응
친 핵성 및 전자 성 치환 반응은 유기 및 무기 화학에서 발견됩니다. 이러한 치환 반응은 특정 화합물의 합성에서 매우 중요하다. 치환 반응은 다른 원자 또는 원자 그룹에 의한 원자 또는 원자 그룹을 대체하는 반응이다. 친 핵성 및 경사적 치환 반응의 주요 차이점은 친 핵성 치환 반응은 친핵체에 의한 잎 그룹의 변위를 포함하는 반면 전자 유전 적 치환 반응은 전기성에 의한 기능 그룹의 변위를 포함한다는 것이다.
주요 영역을 다루었습니다
1. 친 핵성 치환 반응
- 정의, 반응 과정, 예
2. 전자성 치환 반응이란 무엇입니까
- 정의, 반응 과정, 예
3. 친 핵성 및 전자 성 치환 반응의 차이는 무엇입니까
- 주요 차이점 비교
주요 용어 :지방족 및 방향족 화합물, 전기성, 전자 성 치환, 퇴치 그룹, 친 핵성, 친 핵성 치환, s e 1 반응, s e 2 반응, s n 1 반응, s n 2 반응, 치환 반응 
친 핵성 치환 반응이란 무엇인가
친 핵성 치환 반응은 친핵체에 의한 휴가 그룹의 변위를 포함하는 화학 반응이다. 이 잎 그룹은 친핵체가 분자와 반응 할 때 떠날 때 떠나기 때문에 그 이름이 주어진다. 친핵체가 부착 될 부분을 Electrophile이라고합니다. 이 전기는 안정이되기 위해 전자가 부족합니다. 따라서, 그것은 친핵체에서 전자를 받아들입니다. 이것은 친핵체와 전기성 사이의 공유 결합의 형성을 초래한다.
대부분의 경우, 친핵체는 부정적인 하전입니다. 그러나 기증 할 준비가 된 유리 쌍의 전자를 갖는 중립적으로 하전 된 분자 일 수도 있습니다. 이러한 친 핵성 치환 반응은 지방족 및 방향족 유기 화합물에서 발생합니다.
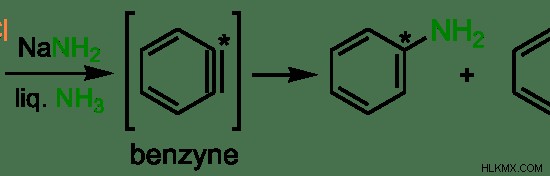
그림 1 :방향족 화합물에서의 친 핵성 치환의 예
위의 예에서 벤젠 고리는 염소 (CL) 원자에 부착됩니다. 그것은 nanh 2 의 존재하에 떠나는 그룹입니다. . 친핵체는 –nh 2 이다 그룹. 탄소 원자 (위 이미지에 별 마크가있는)는 친핵체에 의해 공격을 받고 Cl 원자는 –nh 2 로 변위됩니다. 그룹. 이것을 친 핵성 치환이라고합니다.
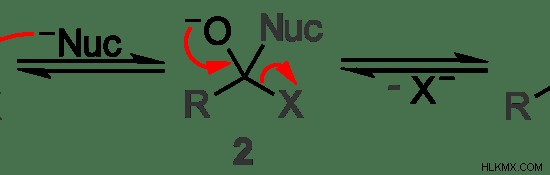
그림 2 :방향족 화합물에서의 친 핵성 치환의 예
위의 예에서 친핵체는 기호 "핵"으로 표시됩니다. 중앙의 탄소 원자는 친핵체에 의해 공격을 받고 잎 그룹 "x"는 친핵체로 변위된다. 위의 이미지에서 첫 번째 분자와 마지막 분자의 차이를 고려할 때 명확하게 볼 수 있습니다.
메커니즘에 따라 분류 된 두 가지 주요 유형의 친 핵성 치환 반응이 있습니다.
s n 1 반응
"s"기호는 "대체"를 말하고 "n"은 "친 핵성"을 나타냅니다. 숫자 (여기서 "1")는 반응의 동역학 순서를 나타냅니다. 이러한 반응은 탄수화물 중간체의 형성을 포함한다. 따라서 반응은 두 단계로 발생합니다.
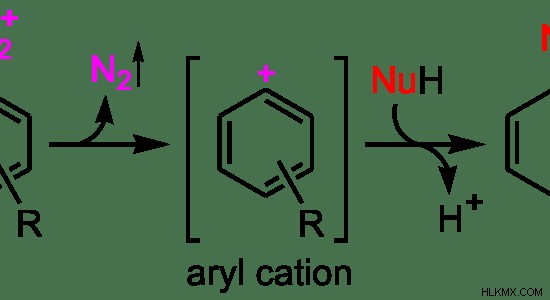
그림 3 :SN1 반응 메커니즘
위의 예에서는 n 2 초기 분자의 떠나는 그룹입니다. 첫 번째 단계로서, 떠나는 그룹은 퇴근하여 탄수화물 중간체를 형성합니다. 여기에 형성된 중간체는 아릴 양이온입니다. 그것은 안정적인 이온이기 때문에 이것은이 반응의 결정 단계입니다. 두 번째 단계로, 친핵체는 탄수화물에 부착된다.
s n 2 반응
s n 2 반응, 탄수화물은 형성되지 않습니다. 따라서 반응은 단일 단계를 통해 발생합니다. 따라서 반응의 속도 결정 단계입니다.
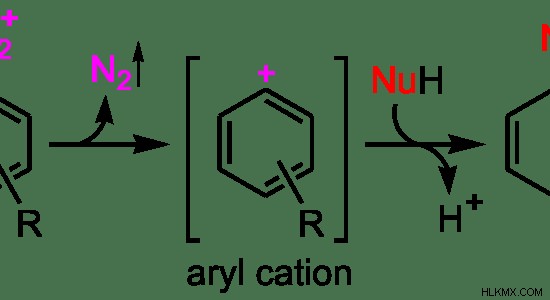
그림 4 :SN2 반응 메커니즘
위의 예는 떠나는 그룹의 떠나기 (여기서“x”)와 동시에 발생하는 친핵체의 대체를 보여줍니다. 더 읽기 :s n 의 차이 1 및 s n 2 반응.
elecropholic substitution 반응이란 무엇인가
Electrophilic Substitution은 전기성에 의한 기능 그룹의 변위를 포함하는 화학 반응입니다. 대부분의 경우, 수소 원자는 이러한 방식으로 변위됩니다. 전자 성 치환 반응은 또한 지방족 및 방향족 화합물에서도 발견된다. 전자 성 치환 반응은 특히 벤젠 유도체를 만드는 데 사용됩니다.
electrophiles는 긍정적으로 하전되거나 중립적으로 하전되지만 전자가 부족한 분자입니다. 전기성은 전하를 중화 시키거나 옥트 규칙에 순종하고 안정적이되기 위해 친핵체에서 전자를 받아들입니다.
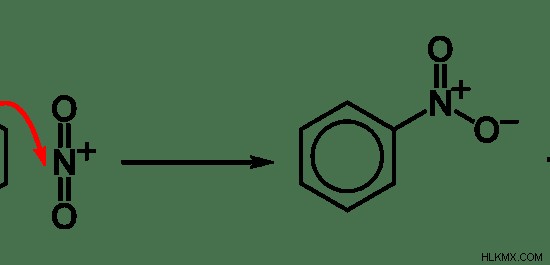
그림 5 :방향족 화합물에서의 전자 성 치환 반응의 예
위의 예에서 벤젠 고리의 수소 원자는
전자 성 치환 반응은 주로 두 가지 유형의 메커니즘에서 발견됩니다.
s e 1 반응
this s e 1 반응은 안정적인 탄수화물의 형성을 포함한다. 따라서, 속도 결정 단계는 탄수화물 형성의 단계이다. 이것은 s e 임을 나타냅니다 1 반응은 두 단계로 발생합니다. 탄수화물에 electrophile을 부착하는 것도 여기에서 관찰 될 수 있습니다. 그러나 떠나는 그룹은 여전히 탄수화물에 첨부되어 있습니다. 두 번째 단계로서, 잎 그룹의 출발이 발생합니다.
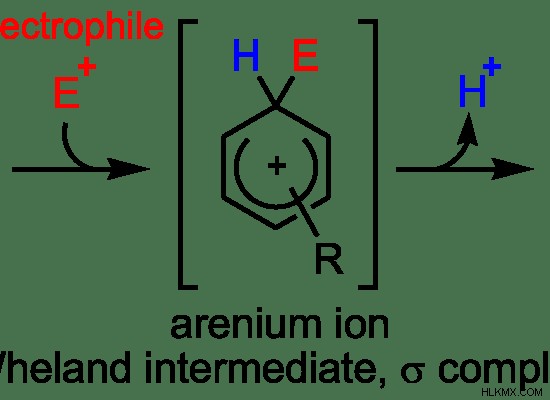
그림 6 :SE1 반응 메커니즘
s e 2 반응
the s e 2 반응에는 한 단계 만 포함됩니다. 탄수화물은 형성되지 않습니다. 따라서 속도 결정 단계는 치환 분자의 형성입니다.
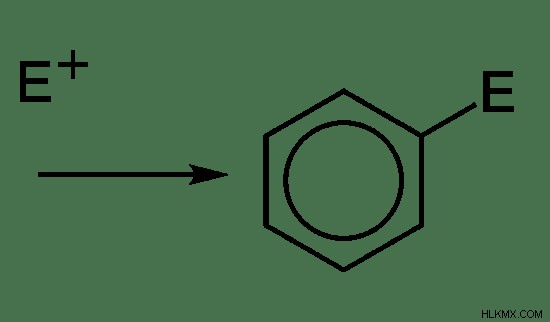
그림 7 :SE2 반응 메커니즘
친 친 성성 및 경사체 치환 반응 사이의 유사성-
두 가지 유형의 반응은 전자 공유와 관련이 있습니다.
-
두 반응 모두 공유 결합을 초래합니다.
-
두 반응 모두 기질 분자에 존재하는 그룹의 변위를 초래한다.
-
그들은 떠나는 그룹을 생산합니다.
-
두 반응 유형 모두 지방족 및 방향족 화합물과 관련된 화학 반응에서 발견됩니다.
친 핵성 및 전자 성 치환 반응의 차이
정의
친 핵성 치환 반응 : 친 핵성 치환 반응은 친핵체에 의한 잎 그룹의 변위를 포함하는 화학 반응이다.
전자 성 치환 반응 : 전자 유전 적 치환은 전기성에 의한 기능적 그룹의 변위를 포함하는 화학 반응이다.
전자 공유
친 핵성 치환 반응 : 친 핵성 치환 반응에서, 친핵체는 전자를 기증한다.
전자 성 치환 반응 : 전자 성 치환 반응에서, Electrophile은 전자를 받아들입니다.
전하
친 핵성 치환 반응 : 친 핵성 치환 반응에서, 친핵체는 음으로 하전되거나 중립적으로 하전되며 전자는 수용 분자가 양전하로 하전되거나 중립적으로 하전된다.
전자 성 치환 반응 : 전자 성 치환 반응에서, 전기성은 양으로 하전되거나 중립적으로 하전되고 전자 기증 분자는 음으로 하전되거나 중립적으로 하전된다.
.결론
친 핵성 및 전자 성 치환 반응은 유기 및 무기 화학에서 근본적인 반응입니다. 친 핵성 및 전자 성 치환 반응의 주요 차이점은 친 핵성 치환 반응은 친핵체에 의한 잎 그룹의 변위를 포함하는 반면, 전자 성 치환 반응은 전기성에 의한 기능적 그룹의 변위를 포함한다는 것이다.
.이미지 제공 :
1.“Benzyne을 통한 대체”(공개 도메인) Commons Wikimedia
2. Ckalnmals에 의한“염기성 촉매 된 핵 아실 치환에 대한 일반적인 계획”-Commons Wikimedia
3을 통한 자체 작업 (CC By-SA 3.0). Benjah-BMM27의“Benzene-Nitration-Mechanisis”-Commons Wikimedia
4를 통한 자신의 작업 (공개 도메인). Commons Wikimedia
5를 통한 "방향족 SN1 메커니즘"(공개 도메인). Poyraz 72의“Mechanismus der SN2 Reaktion-Seite001”-Commons Wikimedia
6을 통한 OWN OUT (CC BY-SA 3.0). Commons Wikimedia를 통한 "Arenium Ion 메커니즘"(공개 도메인)
참조 :
1.” 전자 성 치환.” 전자적 치환이란 무엇입니까? N.P., N.D. 편물. 여기에서 사용할 수 있습니다. 2017 년 6 월 27 일.
2.Hunt, Dr Ian R.“친 핵성 치환.” Ch 8 :친 핵성 치환. N.P., N.D. 편물. 여기에서 사용할 수 있습니다. 2017 년 6 월 27 일.
3.`B. 친 핵성 치환이란 무엇입니까?” 화학 libretexts. LibreTexts, 2016 년 6 월 24 일. 웹. 여기에서 사용할 수 있습니다. 2017 년 6 월 27 일.