주요 차이 - PKA 대 pH
물리 화학에서 pka와 pH는 시스템의 산도와 관련된 두 가지 용어입니다. 이들은 로그 값입니다. 매우 크거나 작은 양을 표현하고 비교하는 가장 쉬운 방법은 로그 값을 취하는 것입니다. 로그는 처리하기가 매우 쉬운 간단한 값을 제공합니다. PKA와 pH의 주요 차이점은 pka가 산의 해리를 나타내는 반면, pH는 시스템의 산도 또는 알칼리도를 나타냅니다.
주요 영역을 다루었습니다
1. PKA
- 정의, 가치, 관계
2. pH
- 정의, 가치, 관계
3. PKA와 pH 의 차이점은 무엇입니까?
- 주요 차이점 비교
주요 용어 :산도, 산 해리 상수, 기본성, pH, pka

pka
pka는 KA의 로그의 음수 값입니다. Ka는 산산 해리 상수에 대한 기호 입니다 . 일부 산은 강 산이고 일부는 약산입니다. 강산은 수용액에있을 때 이온에 완전히 분리됩니다. 그러나 약산은 부분적으로 분리되어 산과 그의 공액 기초 사이의 평형을 생성한다. 예를 들어, HA라는 약산을 고려하면 해리가 다음과 같이 제공 될 수 있습니다. 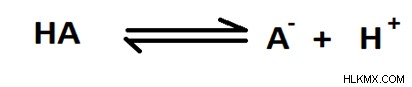
이 평형의 산 분리 상수는
입니다ka =[a] [h]/[ha]
where,
[a] =컨쥬 게이트 염기의 농도
[H] =H+ 이온의 농도
[ha] =산의 농도
그런 다음 산 해리 상수의 PKA 값은 다음과 같이 표시 될 수 있습니다.
pka =-log 10 [ka]
pka 값을 살펴보면 산이 강산인지 약물인지 여부를 결정할 수 있습니다. PKA의 값이 높으면 산이 약합니다. PKA 값이 높을수록 KA가 낮다는 것을 나타 내기 때문입니다. ka의 값이 낮 으려면 [ a] [h] 값은 [ha]의 값보다 낮아야합니다. 이것은 산이 부분적으로 분리되었음을 의미합니다. 그러나 [의 값이라면 A] [H]는 [HA]보다 높고 KA는 높고 PKA는 해당합니다. 이것은 그것이 강산임을 나타냅니다.
란 무엇입니까?
pH는 H 농도의 역수의 로그 값입니다. pH 값은 시스템의 산도 또는 알칼리도를 나타냅니다. 특정 시스템의 pH 값이 높으면 알칼리성 또는 기본 시스템이라고합니다. 시스템의 pH 값이 낮 으면 해당 시스템은 산성입니다. pH의 범위는 1 내지 14이며, pH 값 7은 산도 또는 알칼리도가 존재하지 않는 중성 pH 인 것으로 알려져있다. pH와 PKA의 관계는 다음과 같이 표시 될 수 있습니다. 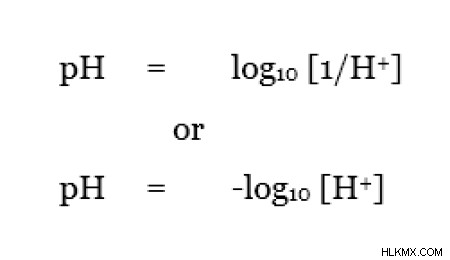
분석 화학에서 pH 지표는 특정 반응의 종말점을 식별하는 데 사용됩니다. 이 지표는 pH 변화에 매우 민감하며 수용액에서 다른 pH 값에 대해 다른 색상을 보여줍니다.
그러나 pH 값은 수역의 산도 또는 알칼리도를 잘 나타내는 것입니다. pH 미터는 물의 pH 또는 다른 용액을 측정하는 데 사용될 수 있습니다.
PKA와 pH의 차이
정의
pka : PKA는 KA의 로그의 음수 값입니다.
pH : pH는 H 농도의 역수의 로그 값입니다.
산도 표시
pka : PKA는 산이 강산인지 약산인지를 나타냅니다.
pH : pH는 시스템이 산성인지 알칼리인지를 나타냅니다.
세부 사항이 주어진
pka : PKA는 수용액에서 산의 해리에 대한 세부 정보를 제공합니다.
pH : pH는 시스템에서 H 이온의 농도에 대한 세부 정보를 제공합니다.
값
pka : 산의 PKA가 높으면 약산이며 산의 PKA가 낮 으면 강산입니다.
pH : 시스템의 pH가 높으면 시스템은 알칼리성이지만 pH가 낮 으면 해당 시스템이 산성입니다.
다른 매개 변수의 효과
pka : PKA는 산, 컨쥬 게이트 염기 및 h.
의 농도에 의존한다.pH : pH는 H 농도에 의존한다.
결론
pka와 pH는 실험실 관행에서 매우 중요한 매개 변수입니다. PKA와 pH의 주요 차이점은 PKA가 산의 해리를 나타내는 반면, pH는 시스템의 산도 또는 알칼리도를 나타냅니다.
.