주요 차이 - 탄수화 vs 카바운
Carbocation and Carbanion은 유기 화학에서 자주 사용되는 두 가지 용어입니다. 이들은 탄소 원자에 전하가있는 유기 화학 종입니다. 탄수화물과 카바이온은 종종 일부 반응의 중간체로 발견됩니다. 탄수화물과 카바 니온의 주요 차이점은 탄수화물이 양전하를 갖는 탄소 원자를 포함하는 반면, 카바리온은 음전하를 갖는 탄소 원자를 함유한다는 것입니다.
주요 영역을 다루었습니다
1. 탄수화물이란?
- 정의, 유형, 형성, 예와의 반응
2. Carbanion이란?
- 정의, 유형, 형성, 예와의 반응
3. 탄수화물과 Carbanion 의 차이점은 무엇입니까?
- 주요 차이점 비교
주요 용어 :탄수화물, 카바 니온, 전자 첨가, 중간체, 메틸 카바 니온, 메틸 탄수화물, 친 핵성 첨가, 1 차 카바 니온, 1 차 탄수화물, 2 차 탄소, 2 차 탄소, 3 차 카바이온, 3 차 탄수화물,
삼각 평면, 피라미드 
탄수화물이란?
탄수화 용어는 양으로 하전 된 탄소 원자를 함유 한 이온으로 정의 될 수 있습니다. 탄수화물은 양으로 하전 된 탄소 원자뿐만 아니라 전체 분자를 말합니다. 탄수화물은 하나 이상의 긍정적 인 요금을 가질 수 있습니다. 탄소 원자의 p 궤도는 전자 손실로 인해 자유롭기 때문에 이러한 탄소는 일반적으로 불안정하다. 따라서 탄소는 종종 반응성이 매우 높습니다. 이것은 탄수화물과 친핵체 사이의 반응을 선호합니다. 탄수화는 불완전한 전자 페어링으로 인해 상자성입니다. 일반적으로 탄수화물은 SP 혼성화를 보여줍니다. 양전하가있는 탄소 원자는 주위에 3 개의 결합 만 가질 수 있기 때문입니다. 이 탄소 주변의 형상은 삼각 평면입니다.
일반적으로 탄소가 긍정적으로 하전 된 탄소 원자가.
에 부착 된 탄소 원자의 수에 따라 4 개의 그룹으로 나뉩니다.탄수화물 유형
메틸 탄수화물
이 탄소는 다른 탄소 원자에 부착되지 않은 양으로 하전 된 탄소 원자를 포함합니다.

그림 01 :메틸 탄수화물
1 차 탄수화물
여기서, 탄수화물의 양으로 하전 된 탄소 원자는 공유 결합을 통해 다른 탄소 원자에 연결됩니다. 이 유형의 탄수화물은 메틸 탄수화물보다 안정적이지만 다른 탄소보다 안정적입니다.
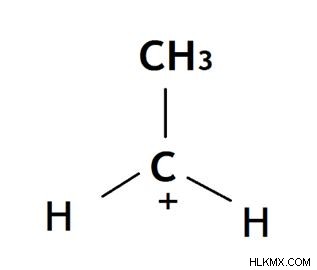
그림 02 :1 차 탄수화물. 여기서 –hh3 그룹은 양으로 하전 된 탄소 원자에 부착됩니다.
2 차 탄수화물
긍정적으로 하전 된 탄소 원자는 2 개의 다른 탄소 원자에 결합됩니다. 이 탄소는 1 차 탄소보다 안정적입니다.
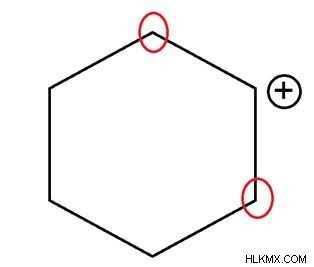
그림 03 :보조 탄수화물. 여기서, 양으로 하전 된 탄소 원자는 2 개의 다른 탄소 원자에 결합된다. 이 두 탄소 원자는 적색 원으로 표시됩니다.
3 차 탄수화물
양으로 하전 된 탄소 원자는 3 개의 다른 탄소 원자에 부착된다. 이 형태는 매우 안정적입니다.
그림 04 :3 차 탄수화물
탄산 형성
휴가 그룹과 탄소 원자 사이의 결합을 깨기
유기 분자에 좋은 휴가 그룹이 있으면 분자를 이온화를 통해 떠날 수 있습니다. 이 이온화는 결합 전자 쌍을 떠나는 그룹에 전자 쌍을 제공하여 탄소 원자에 양전하가 발생합니다.
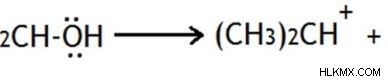
전자 첨가
electrophile은 pi 결합을 공격하고 비닐 탄소 원자 중 하나와 공유 결합을 만들 수 있습니다. 이로 인해 다른 비닐 탄소 원자는 전자 부족으로 인해 양전하가 발생합니다.

그림 06 :“X”의 전자 첨가
탄소의 높은 반응성으로 인해 화학 반응을 매우 쉽게 겪습니다.
탄수화물 반응
친 핵성 첨가
친핵체는 전자가 풍부한 화학 종이다. 탄소 원자와 공유 결합을 형성함으로써 탄수화물의 양으로 하전 된 탄소 원자에 전자를 기증 할 수있다.
.
그림 07 :H2O의 산소 원자의 전자 쌍은 탄수화물에 기증 될 수 있습니다
재 배열
탄수화물은 본딩 전자를 인접한 본드로 교환하여 기존 탄수화물 이외의 안정적인 탄수화물을 형성 할 수 있습니다.

그림 08 :탄수화물 재 배열
위의 이미지는 탄수화물의 재 배열을 보여줍니다. 그곳에서 양전하는 한 탄소 원자에서 다른 탄소 원자로 이동합니다. 그러나 새로운 구조는 2 차 탄수화물이기 때문에 안정적입니다. 초기 이온은 1 차 탄수화물이었다.
Carbanion
Carbanion은 음으로 하전 된 탄소 원자를 포함하는 이온입니다. 탄수화물과 달리, 음전하를 갖는 탄소 원자는 SP 하이브리드 화되고 기하학은 피라미드 (벤질 카바이온 제외)입니다. 탄소 원자의 가장 바깥 쪽 궤도는 8 개의 전자를 갖는 옥트 규칙을 준수합니다. Carbanion은 거의 항상 친척으로 작용합니다. 따라서 전기와 반응 할 수 있습니다. 전자 페어링 완료로 인해 카바 니온은 디아마그네틱합니다.
다양한 유형의 카바 니온
메틸 카바이온
음으로 하전 된 탄소 원자는 다른 탄소 원자에 결합되지 않습니다.
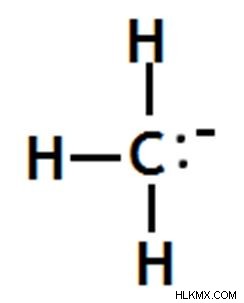
그림 09 :메틸 카바이온
1 차 카바이온
여기서 카바 니온의 음으로 하전 된 탄소 원자는 공유 결합을 통해 다른 탄소 원자에 연결됩니다.
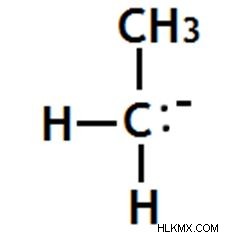
그림 10 :1 차 카바리온
Secondary Carbanion
음으로 하전 된 탄소 원자는 2 개의 다른 탄소 원자에 결합됩니다.
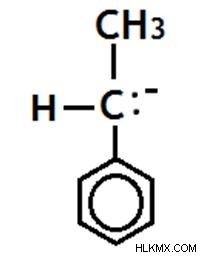
그림 11 :2 차 카바리온
3 차 Carbanion
음으로 하전 된 탄소 원자는 3 개의 다른 탄소 원자에 부착됩니다.
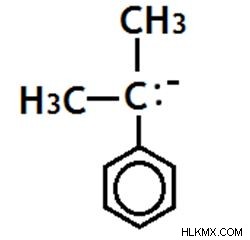
그림 12 :3 차 Carbanion
카바 니온은 그룹이나 원자가 결합 전자를 떠날 때 형성됩니다.
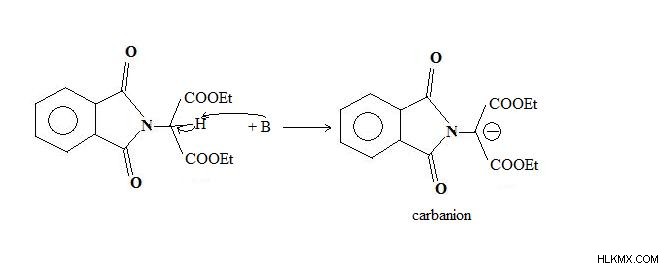
그림 13 :H 원자는 양성자로 잎을 잎으로, 결합 전자 쌍을 탄소 원자에 제공
Carbanions는 주로 친핵체 역할을 할 수있는 전자 성 추가 반응을 겪습니다. 따라서 그들은 전기와 반응합니다.
카바 니온의 주요 반응
첨가 반응
그림 14 :Benzyl Carbanion에서 음으로 하전 된 탄소 원자는 SP2 하이브리드 화되고 평면 형상이 있습니다. (이것은 위에서 언급 한 바와 같이 예외입니다)
재 배열

그림 15 :카바니온의 공명 구조
가장 안정적인 구조를 얻기 위해 카바나니아의 구조를 변경할 수 있습니다. 본딩 전자 쌍을 이동할 수 있습니다. 이로 인해 Carbanion이 Carbanion이 아닌 정상적인 이온이됩니다.
탄수화와 카바 니온의 차이
정의
탄수화물 : 탄소 위치는 양으로 하전 된 탄소 원자를 함유하는 이온입니다.
Carbanion : Carbanion은 음의 하전 탄소 원자를 함유 한 이온입니다.
혼성화
탄수화물 : 양전하를 갖는 탄소 원자는 탄수화물에서 sp 혼성화됩니다.
Carbanion : 음전하를 갖는 탄소 원자는 카바 니언에서 sp 하이브리드 화됩니다.
기하학
탄수화물 : 탄소 원자의 형상은 탄소의 삼각 평면입니다.
Carbanion : 탄소 원자의 기하학은 카바 니언의 피라미드입니다.
자기 특성
탄수화물 : 탄수화물은 상자성입니다.
Carbanion : Carbanion은 diamagnetic입니다.
반응
탄수화물 : 탄수화물은 화학 반응에서 전기성 역할을합니다.
Carbanion : Carbanion은 화학 반응에서 친핵체 역할을합니다.
결론
카보로 위치 및 카바니언은 탄소 원자에 전하가있는 유기 화학 종을 참조하십시오. 탄수화물과 카바 니온의 주요 차이점은 탄수화물이 양전하를 갖는 탄소 원자를 포함하는 반면, 카바 니온은 음전하를 갖는 탄소 원자를 함유한다는 것입니다.
.