핵심 개념
이 튜토리얼에서는 이온 다이폴 힘과 이온 유발 쌍극자 힘에 대해 배울 것입니다.
다른 기사에서 다루는 주제
- 양이온 및 음이온
- 다 원자 이온
- 쌍극자 순간은 무엇입니까?
- 채권 주문 대 채권 길이
- 반 데르 발스 세력
어휘
이온 - 하나 이상의 전자의 손실 또는 게인으로 인해 양전하 또는 음전하가있는 원자 또는 분자.
쌍극자 - 거리에 의해 분리 된 반대 전하가있는 두 개의 극을 가진 분자.
정전기 상호 작용 - 전기 전하 분자 사이의 매력적이거나 반발하는 상호 작용.
분자간 힘 - 분자 사이의 물리적 힘.
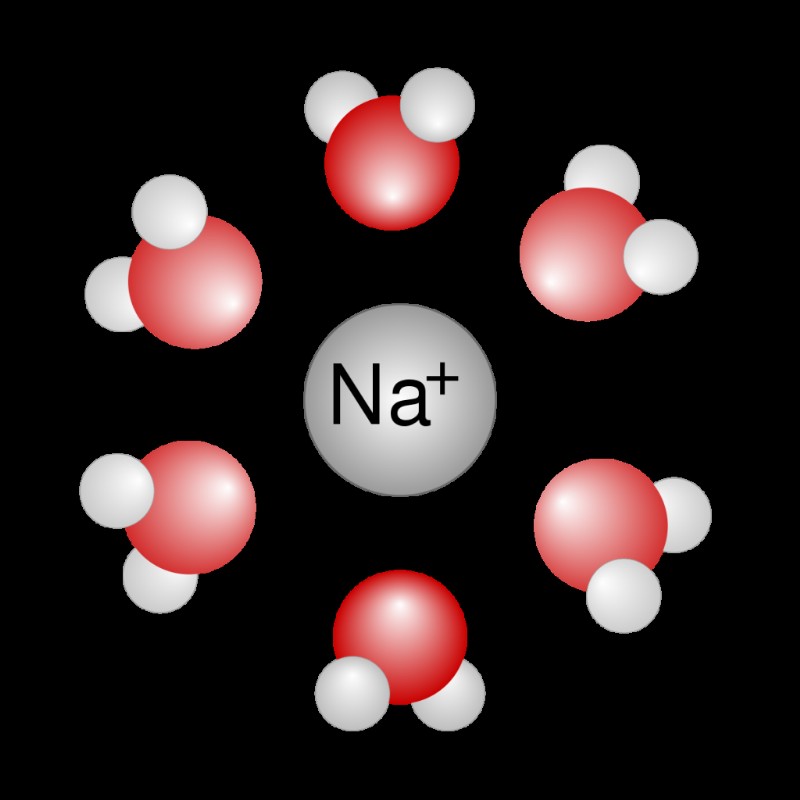
이온 다이폴 세력
이온 다이폴 힘은 정전기 상호 작용 입니다 완전히 전하 된 이온과 쌍극자가있는 중성 분자 사이. 또한 intermecular force 입니다 그것은 용액, 특히 극성 액체에 용해 된 이온 성 화합물에서 가장 일반적으로 발견됩니다.
이온의 전하는 분자의 어느 부분이 유치하고 격퇴하는지 결정합니다. 따라서 양이온은 분자의 부분적으로 부정적인 끝을 끌어들이는 반면 음이온은 분자의 부분적으로 양성 끝을 끌어냅니다.
이온 다이폴 힘의 예 :
na (나트륨 이온) 및 H 2 O (물 분자)
NA :양이온
h 2의 부분적으로 긍정적 인 끝 O :h 원자에서
H 2의 부분적으로 부정적인 끝 O :O Atom에서
→ 나트륨은 수 분자의 산소 원자를 끌어 들이고 수소 원자를 격퇴합니다.
이온 유발 쌍극자 력
이온-유도 쌍극자 힘은 이온이 비극성 분자와 상호 작용할 때 발생하는 약한 매력이다. 더욱이, 완전히 하전 된 이온이 비극성 분자에 접근 할 때, 전자는 반응하고 분자는 쌍극자를 형성한다; 따라서, 이온은 비극성 분자를 분극한다.
양이온은 전자 구름을 끌어서 분자를 편광시키는 반면 음이온은 전자 구름을 방출하여이를 수행합니다.
이온 유발 쌍극자 힘의 예 :
no
아니오
i 2 :비극성 분자
→ 질산염 이온의 존재하에 요오드 분자가 편광됩니다.







