주요 차이 - pH 대 산도
pH 및 acidity는 서로를 설명하는 관련 용어입니다. 산도는 용액에 존재하는 히드로 늄 이온의 양이다. pH는 용액에 존재하는 하이드로 늄 이온의 양을 측정하는 데 사용되는 스케일이다. 따라서, pH는 시스템의 산도를 정량화 할 수있다. 이 용어는 종종 수중 화학에 사용되며 수역의 행동과 특성을 설명합니다. pH와 산도의 주요 차이점은 pH가 용액의 산도 또는 기본성의 정량적 측정이라는 것입니다 산도는 용액의 산성 특성의 질적 측정입니다.
주요 영역을 다루었습니다
1. pH
- 정의, 값, 속성
2. 산도 가란?
- 정의, 속성
3. pH와 산도의 관계는 무엇입니까
- 일반적인 기능의 개요
4. pH와 산도의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :산 해리 상수, 산도, 염기성, 하이드로 늄 이온, 리트머스, 모노 프 로스 성, PH, 강산, 약산 
란 무엇입니까?
pH는 시스템의 산도 또는 기본성을 측정하는 데 사용되는 스케일입니다. 일반적으로, pH의 척도는 1에서 14로 주어진다. 이들 pH 값은 로그 값이기 때문에 단위가 없다. pH는 히드로 늄 이온 농도의 역의 로그로 정의 될 수있다. 이것은 아래와 같이 수학적 기호로 제공 될 수 있습니다.
ph =-log 10 [h 3 o (aq) ]
시스템의 pH는 시스템이 산성인지 기본인지를 나타낼 수 있습니다. pH 7은 중성 pH로 간주된다. PH 7에는 순 산도 또는 염기성이 없기 때문입니다. 그러나 특정 시스템이 pH 7 미만의 pH 값을 갖는 경우 해당 시스템을 산성 시스템으로 알려져 있습니다. 여기에는 더 많은 산성 종이 존재합니다. 시스템의 pH가 pH 7 이상인 경우 해당 시스템을 기본 시스템이라고합니다. 여기에는 더 기본적인 종이 존재합니다.
시스템의 pH 값을 계산할 때 히드로 늄 이온의 농도는 단위 mol/L에서 취합니다. 따라서 시스템의 pH를 계산하기 위해 먼저 H 3 의 농도를 측정해야합니다. o 다음 위의 방정식에서 사용하십시오. 기본성과 관련하여 POH 값은 pH 대신 측정됩니다. POH는 pH와 동일하게 계산되지만 OH 농도는 먼저 측정됩니다.

그림 1 :pH 미터
pH 미터를 사용하여 pH를 쉽게 측정 할 수 있습니다. 이러한 유형의 pH 미터 중 하나가 위 이미지에 표시됩니다. 용액의 pH는 해당 용액에서 pH 미터의 프로브를 담그면 측정 할 수 있습니다. 담그면 버튼 "읽기"를 밀어야합니다. 그런 다음 용액의 pH가 화면에 표시됩니다.
acidity
acidity는 특정 시스템의 산성 특성의 정도입니다. 산도는 하이드로 늄 이온의 존재로 표시됩니다 (H 3 o) 솔루션에서. 따라서, 산도는 또한 특정 시스템에 존재하는 히드로 늄 이온의 양으로 정의 될 수있다. 용액의 산도는 pH로 측정된다. 산성 특성이 높은 물질을 산이라고합니다. 이들 물질은 이온화를 통해 양성자 (H 이온)를 방출 할 수 있으며 용액에서 하이드로 늄 이온을 형성 할 수있다. 이들 히드로 늄 이온은 용액의 산도를 유발한다. 이온화 과정에 따르면, 강산과 약산이 있습니다. 강산은 완전히 이온화되어 용액에 가능한 모든 양성자를 방출 할 수 있습니다. 약산은 부분적으로 일부 양성자를 이온화하고 방출하여 평형을 초래합니다.
산 해리 상수는 솔루션의 산도에 대한 아이디어를 제공합니다. 예를 들어, 산“ha”의 해리를 고려해 봅시다.
ha +h 2 o sub a +h 3 o
HA의 산 해리 상수는 다음과 같이 제공됩니다.
ka =[a] [h 3 o] / [ha]
위의 방정식에 따르면, 히드로 늄 이온 농도의 변화는 KA 값을 변화시킬 수 있습니다. 따라서 용액의 KA 값이 높을수록 더 산성입니다. KA 값이 낮 으면 솔루션의 산도가 낮습니다.
일부 산은 하나의 양성자 (또는 하나의 히드로 늄 이온)를 방출 할 수있는 반면 다른 산은 더 많은 양성자를 방출 할 수 있습니다. 따라서, 용액의 산도는 또한 존재하는 산성 물질의 단일 분자에 의해 얼마나 많은 히드로 늄 이온이 형성되는지에 달려있다.
.acidity는 리트머스 용지를 사용하여 쉽게 결정할 수 있습니다. 블루 리트머스가 특정 용액에 담그면 붉은 색으로 바뀌면 해당 용액을 산성 용액으로 인식 할 수 있습니다.
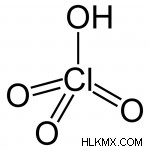
그림 2 :과염소산
위의 이미지는 과염소산의 구조를 보여줍니다. 방출 될 수있는 하나의 양성자 (H+ 이온)가 있습니다. 그래서 그것은 모노 프 로스 산입니다. 과염소산의 수용액은 산도가 높습니다.
pH와 산도 사이의 관계
- pH와 산도는 솔루션의 산성 특성을 측정 할 수 있습니다.
- pH는 산도의 정량적 측정입니다.
- 산도는 용액에 존재하는 히드로 늄 이온의 양이기 때문에 pH는 산도 역의 로그 값입니다.
- pH 값이 높아지면 시스템의 산도가 낮아집니다.
- pH 값을 낮추고 시스템의 산도가 높아집니다.
pH와 산도의 차이
정의
pH : pH는 히드로 늄 이온 농도의 역수 로그로 정의 될 수있다.
산도 :산도는 특정 시스템의 산성 특성의 정도입니다.
자연
pH : pH는 솔루션의 산도 또는 염기성의 정량적 측정입니다.
산도 :산도는 용액의 산성 특성의 질적 측정입니다.
단위
pH : pH 값은 단위가 없습니다.
산도 :산도는 mol/l 단위로 측정 할 수 있습니다.
기초성
pH : pH는 용액이 산성인지 염기성인지를 나타냅니다.
산도 :산도는 솔루션이 기본인지를 나타낼 수 없습니다.
결론
순수한 물에는 산성 또는 기본 종이 용해되지 않기 때문에 pH 값 7이 주어집니다. 그러나 우리가 일반적으로 사용하는 물은 종종 6.5에서 7.5 사이의 pH 값을 갖습니다. 물이 좋은 용매이기 때문에 많은 화학 종이 물에 용해되기 때문입니다. 그러나, 물의 산도는 pH로 나타납니다. 7 미만의 pH 값은 산성으로 알려져있다. pH 값이 매우 낮 으면 (약 pH =2), 해당 용액은 강한 산성이라고하며 pH 7 근처의 pH 값 (그러나 7 미만)을 약한 산성이라고합니다. 따라서 pH와 산도의 차이와 그 관계의 차이를 이해하는 것이 매우 중요합니다.