주요 차이 - 원자가 대 용인
원자가와 원자가는 원자에 존재하는 전자와 관련하여 설명됩니다. 전자는 핵 주변의 껍질 또는 궤도에 위치한 것으로 알려져 있습니다. 따라서, 전자는 이들 전자와 원자의 핵 사이의 인력의 강도에 따라 원자에서 손실 될 수있다. 원자가와 원자가는 원자의 가장 바깥 쪽 궤도의 전자와 관련이 있습니다. 원자가와 원자가의 주요 차이점은 원자가는 원자가 다른 원자와 결합 될 수있는 능력을 의미한다는 것입니다 analency는 스스로 안정화하기 위해 원자가 잃거나 얻을 수있는 최대 전자 수를 말합니다.
주요 영역을 다루었습니다
1. 원자가는 무엇입니까
- 정의, 예제에 대한 설명
2. 원자가
- 정의, 예제에 대한 설명
3. 원자가와 원자가의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 원자가와 원자가의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 탄소 원자, 전자, 수소 원자, 질소, 옥트 규칙, 궤도 다이어그램, 원자가, 원자가, 밸런스 
밸런스
원자가는 원자가 다른 원자와 결합 될 수있는 능력을 나타냅니다. 다시 말해, 그것은 특정 원자의 강도를 결합하는 정도입니다. 원자의 원자가는 원자의 가장 외부 궤도에 존재하는 전자의 수와 관련이있다. 이 전자는 원자가 전자라고합니다. 다른 원자와 결합 되려면, 특정 원자는 손실, 이득 또는 짝을 이룰 수있는 원자가 전자를 가져야한다. 이는 두 원자의 조합이 이온 결합 또는 공유 결합을 통해 일 수 있고, 이들 유형 모두에서 원자는 전자를 잃거나 전자를 얻거나 전자를 공유합니다.
.원자의 원자가는 해당 원자에 부착 될 수있는 일형 원자의 수 또는 원자가 가질 수있는 단일 결합의 수로 주어질 수 있습니다. 이것은 또한 원자에 부착 될 수있는 수소 원자 (H)의 수로 정의 될 수있다. 이것은 수소 원자가 이동적이며 다른 원자와 쉽게 결합 할 수 있기 때문입니다. 일부 원자는 다른 비율의 다른 원자에 결합 될 수 있습니다. 따라서 원자는 여러 원자가를 가질 수 있습니다.
원자가 =결합 강도의 정도
=부착 할 수있는 원본 원자 수
=부착 할 수있는 H 원자 수.
예를 들어, 수소 원자는 하나의 수소 원자 또는 다른 단일 원자 원자에만 부착 될 수 있습니다. 따라서 수소의 원자가는 1입니다.

그림 01 :수소의 원자 구조
수소의 전자 구성 :1s
궤도 다이어그램 수소의 : 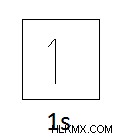
따라서 수소는 들어오는 전자를위한 공간이 하나뿐입니다. 그렇지 않으면 수소는 하나의 전자 만 잃을 수 있습니다. 따라서 하나의 아이디어 원자와 결합 할 수 있습니다. 따라서 수소의 원자가는 1입니다.
질소를 고려해 봅시다. 질소의 원자 수는 7입니다.
질소의 전자 구성 :1S2S2p
질소의 궤도 다이어그램 : 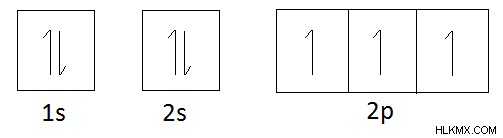
질소의 궤도 다이어그램에 따르면 들어오는 전자를위한 3 개의 공간이 있습니다. 이는 3 개의 짝을 이루지 않은 전자를 가지고 있으며 다른 원자에서 전자를 공유하여 짝을 이룰 수 있기 때문입니다. 다시 말해, 질소는 1, 2 또는 3 개의 수소 원자에 결합 될 수있다. 또는 질소는 1, 2 또는 3 개의 전자를 잃을 수 있습니다. 따라서 원자는 여러 원자가를 가질 수 있습니다.
또한 원자의 원자가는 양수 (+) 또는 음수 (-) 마크로 표시됩니다. 이것은 전자의 손실 또는 이득을 보여주는 것입니다. 위의 예에서, 수소의 원자가는 +1 또는 -1 일 수있다. 질소의 원자가는 -3, -2, -1, +2, +3입니다.
analency
analency는 자체를 안정화시키기 위해 원자가 잃거나 얻을 수있는 최대 전자 수입니다. 이 용어는 주로 원자가 전자의 수가 특정 원자의 원자가를 결정하기 때문에 주로 원자가 전자와 관련이 있습니다.
예를 들어, 탄소 원자를 고려해 봅시다.
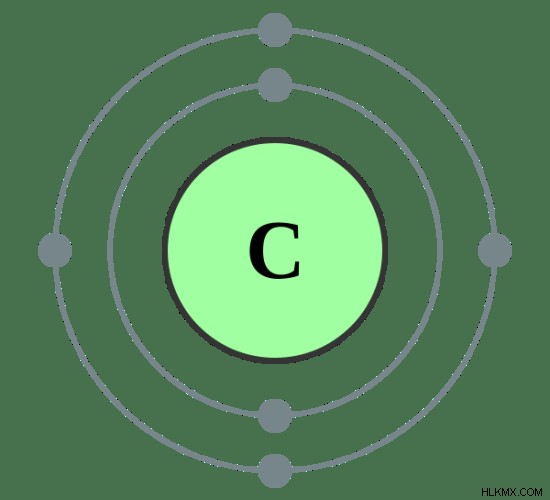
그림 02 :탄소의 원자 구조
탄소 1S2S2P의 전자 구성
탄소의 궤도 다이어그램 : 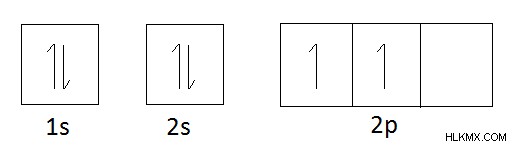
탄소의 궤도 다이어그램에 따르면 옥트 규칙에 순종하기 위해 4 개의 전자를 얻어야합니다. ( Octet Rule 원자의 가장 바깥 쪽 궤도에있는 총 8 개의 전자가 그 원자의 가장 안정적인 형태임을 나타냅니다). 4 개의 전자를 얻은 후, n =2 궤도 (2s 및 2p)의 총 전자 수는 8이된다. 따라서 탄소의 원자가는 4이다.
.원자가와 원자가 사이의 유사성
원자의 원자가는 그 원자의 원자가 중 하나와 같습니다. 이는 원자에 의해 손실, 획득 또는 공유 할 수있는 최대 전자 수가 해당 원자의 조합 강도를 결정하기 때문입니다. 따라서 정의는 다르지만 원자가와 원자가의 값은 동일 할 수 있습니다.
원자가와 원자가의 차이
정의
원자가 : 원자가는 원자가 다른 원자와 결합 될 수있는 능력입니다.
원자가 : 원자가는 자체를 안정화시키기 위해 원자가 잃거나 얻을 수있는 최대 전자 수입니다.
표현
원자가 : 원자가는 정수로 제공되며, + 또는 - 숫자 앞에 서명으로 표시됩니다.
원자가 : 원자가는 + 또는 - 부호가없는 숫자로만 제공됩니다.
값
원자가 : 원자의 원자가는 여러 값을 가질 수 있습니다.
원자가 : 원자의 원자가는 값이 하나뿐입니다.
결론
원자의 원자가와 원자가가 동일한 개념을 지칭하더라도 정의와 표현에 따라 원자가와 원자가 사이에는 약간의 차이가 있습니다. 원자가는 원자가 가질 수있는 결합의 수를 제공하는 반면, 원자가는 원자가 가질 수있는 최대 결합 수를 제공합니다.
.이미지 제공 :
1.“전자 쉘 001 수소-라벨 없음”커뮤니케이션 :사용자 :Pumbaa (Commons의 원본 작품 :사용자 :Greg Robson) (해당 레이블로 표시된 버전), (CC BY-SA 2.0 UK) Commons Wikimedia
2. Pumbaa (Greg Robson의 원본 작품)의 "Electron Shell 006 Carbon-라벨 없음"-파일 :전자 쉘 006 Carbon.svg (CC By-SA 2.0 UK) Commons Wikimedia