주요 차이 - CV vs CP
열역학은 열 에너지와 다른 형태의 에너지와의 관계를 설명하는 물리 화학의 분기입니다. CV와 CP는 열역학에 사용되는 두 가지 용어입니다. CV는 일정한 부피의 비열 입니다 CP는 일정한 압력에서의 비열 입니다 . 비열은 물질의 온도 (단위 질량 당)를 1도 섭씨로 높이는 데 필요한 열 에너지입니다. CV와 CP의 주요 차이점은 부피 변화가 CV에 따른 시스템의 0이라는 것입니다 cp. 에 따른 시스템의 압력 변화는 0입니다.
주요 영역을 다루었습니다
1. CV
- 정의, 속성, 공식
2. cp
- 정의, 속성, 공식
3. CV와 CP의 관계는 무엇입니까
- 일반적인 기능의 개요
4. CV와 CP의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :CP, CV, 비열, 압력, 열역학, 부피 
cv
cv는 물질이 흡수하거나 방출하는 열 에너지의 양입니다 (단위 질량 당)은 볼륨 변화가 발생하지 않는 온도의 변화와 함께 (단위 질량 당). 다시 말해, 시스템 부피의 변화없이 시스템과 주변 사이에 전달되는 열 에너지입니다.
이 용어는 시스템의 내부 에너지와 관련이 있습니다. 내부 에너지는 시스템의 잠재력과 운동 에너지의 합입니다. 해당 시스템의 온도가 변경되면 시스템은 외부에서 에너지를 흡수하거나 에너지를 주변으로 방출 할 수 있습니다. 이러한 내부 에너지의 변화가 일정한 부피에서 발생하면 일정한 부피의 비열 인 CV입니다. 이것은 다음과 같이 상징 될 수 있습니다.

여기서,
cv 일정한 부피의 비열
du 내부 에너지의 변화입니다
dt 온도의 변화 입니다
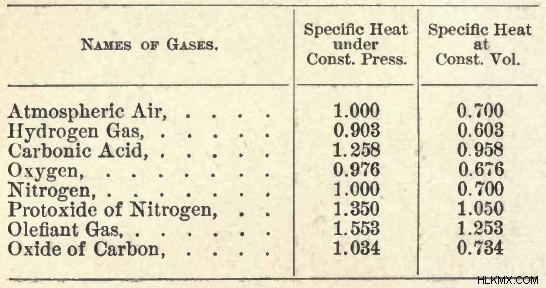
그림 01 :일부 가스의 비열 테이블.
위의 이미지는 일부 일반적인 가스의 특정 열 테이블을 보여줍니다. 일정한 압력 및 일정한 부피의 비열은 cal/g/c의 단위에 나와 있습니다.
cp
cp는 일정한 압력의 비열입니다. 일정한 압력에서 온도의 변화로 물질의 단위 질량에 의해 방출되거나 흡수되는 에너지의 양입니다. 다시 말해, 그것은 시스템과 일정한 압력 하에서 주변 사이에서 전달되는 에너지입니다.
이 용어는 시스템의 엔탈피와 관련이 있습니다. 엔탈피는 에너지가 흡수되거나 방출됩니다. 내부 에너지의 합계 및 압력 및 부피의 산물로 정의됩니다. 이는 시스템이 흡수하거나 출시되는 총 에너지가 시스템이 이미 가지고있는 에너지 (내부 에너지)와 시스템에서 발생하는 변화 (PV)와 같기 때문입니다. 온도의 변화는 시스템의 엔탈피를 변화시킬 것입니다. 따라서 이것은 다음과 같이 주어질 수 있습니다.

여기서,
cp 일정한 압력의 비열입니다
dh 엔탈피 변화 입니다
dt 온도의 변화 입니다
CV와 CP 간의 관계
- 물질의 이상적인 가스 거동을 고려하여 다음 관계가 주어질 수 있습니다.
cp-cv =r
여기서 r은 범용 가스 상수입니다.
- CP와 CV의 비율은 비열 비율 인 γ입니다.
γ =cp /cv
CV와 CP 간의 차이
정의
cv : CV는 물질이 부피 변화가 발생하지 않는 온도의 변화와 함께 (단위 질량 당) (단위 질량 당)를 흡수하거나 방출하는 열 에너지의 양입니다.
cp : CP는 압력 변화가 발생하지 않는 온도 변화와 물질이 흡수하거나 방출하는 열 에너지의 양입니다.
상수 매개 변수
cv : 이력서에서는 부피가 일정합니다.
cp : CP에서는 압력이 일정합니다.
관련 매개 변수
cv : CV는 시스템의 내부 에너지와 관련이 있습니다.
cp : CP는 시스템의 엔탈피와 관련이 있습니다.
결론
특정 열은 물질의 열역학적 특성입니다. 이러한 특성은 해당 시스템의 온도 변화가있는 물질 또는 시스템의 거동을 설명합니다. 비열의 개념은 이상적인 가스의 경우 사실이지만 정상 가스와 함께 사용할 때는 종종 수정해야합니다. 가스의 거동은 일반적으로 온도와 압력에 의존하기 때문입니다.
참조 :
1. "온도 변화와 열 사이의 관계." 2.4 비열. N.P., N.D. 편물. 여기에서 사용할 수 있습니다. 2017 년 7 월 18 일.
2.”열 용량.” 위키 백과. Wikimedia Foundation, 2017 년 7 월 13 일. 웹. 여기에서 사용할 수 있습니다. 2017 년 7 월 18 일.
이미지 제공 :
1. William A. Kelley의“특정 열 테이블”-Commons Wikimedia를 통한 OWN OUT (CC BY-SA 4.0)