주요 차이 - 부탄 대 이소 부탄
butane은 유기 화합물입니다. 이 분자는 이성질체로 알려진 여러 형태로 발견 될 수 있습니다. 이소 부탄은 부탄의 구조적 이성질체입니다. 부탄과 이소 부탄은 모두 기체 탄화수소 화합물이다. 이들 화합물은 C 및 H 원자로 만 구성되기 때문에 탄화수소이다. 부탄과 이소 부탄은 모두 동일한 화학적 공식을 갖습니다. c 4 H 10 . 따라서 그들은 동일한 어금니 질량 값을 가지고 있습니다. 이들 화합물은 가연성이므로 연소를위한 연료로 사용될 수있다. 부탄과 이소 부탄의 주요 차이점은 부탄이 선형 또는 분지 분자 일 수 있지만 이소 부탄은 본질적으로 분지 분자라는 것입니다.
주요 영역을 다루었습니다
1. 부탄이란?
- 정의, 속성 및 응용 프로그램
2. 이소 부탄이란?
- 정의, 속성 및 응용 프로그램
3. 부탄과 이소 부탄의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 부탄과 이소 부탄의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :부탄, 연료, 이소 부탄, 이성질체, 탄화수소 
부탄이란?
butane은 이성질체라고 알려진 여러 형태로 발생할 수있는 탄화수소입니다. 부탄의 화학적 공식은 c 4 입니다 H 10 . 탄소 원자 사이에 이중 결합이 없기 때문에 그것은 알칸입니다. 부탄의 몰 질량은 약 58 g/mol입니다. 실온과 대기압에서 Butane은 휘발유와 같은 냄새가있는 무색 가스입니다.
부탄의 주요 원천은 원유입니다. 원유는 부탄이 작은 성분입니다. 부탄은 또한 석유 정제의 부산물입니다. 여러 이성질체 형태로 발생할 수 있습니다. 이 이성질체를 구조 이성질체라고합니다. 부탄의 이성질체는 N- 부탄과 이소 부탄의 두 가지 이성질체가있다. N- 부탄은 부탄의 선형, 직선 사슬 형태입니다. 이소 부탄은 부탄의 분지 구조입니다. 부탄이라는 용어는이 이성질체 중 하나 또는이 이성질체의 혼합물을 설명하는 데 사용될 수 있습니다.
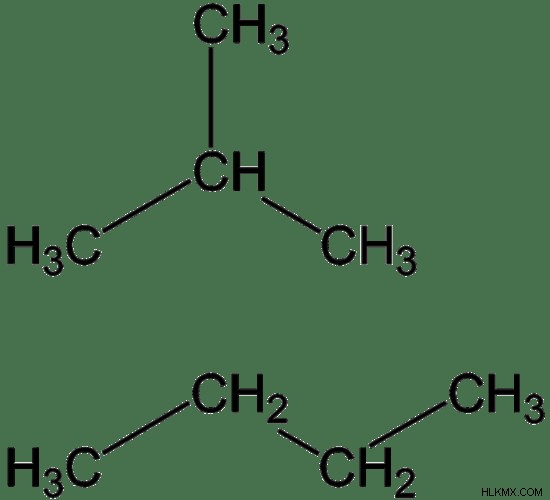
그림 1 :부탄의 2 개의 이성질체; 이소 부탄 (상단) 및 N- 부탄 (하단)
butane은 산소가있을 때 타올 수 있습니다. 부탄은 가연성이 높기 때문입니다. 산소가 충분하면 부탄은 완전한 연소를 겪습니다. 산소가 충분하지 않으면 부탄은 불완전한 연소를 겪게됩니다. 두 경우 모두 연소는 열 에너지를 생성합니다.
butane은 휘발유의 휘발을위한 강화제로 사용할 수 있습니다. 따라서 부탄은 때때로 가솔린에 첨가물입니다. Butane은 연료로 직접 사용할 수 있습니다. 예를 들어, 요리와 같은 가정용 목적으로 쉽게 액화되어 판매 할 수 있습니다. 부탄의 끓는점은 1C 이하이므로 부탄 액체는 즉시 실온에서 기화됩니다.
이소 부탄이란?
isobutane은 n- 부탄의 구조적 이성질체입니다. 이소 부탄의 화학적 공식은 c 4 이다 H 10 . 이소 부탄의 몰 질량은 약 58 g/mol입니다. 분지 구조를 가진 알칸입니다. 여기서, 3 개의 메틸기 및 H 원자는 중심 탄소 원자에 결합된다. 이소 부탄의 중심 탄소 원자 주변의 기하학은 사면체입니다. 이소 부탄은 또한 실온 및 대기압에서 무색 가스입니다. N- 부탄과 달리 냄새가없는 가스입니다.
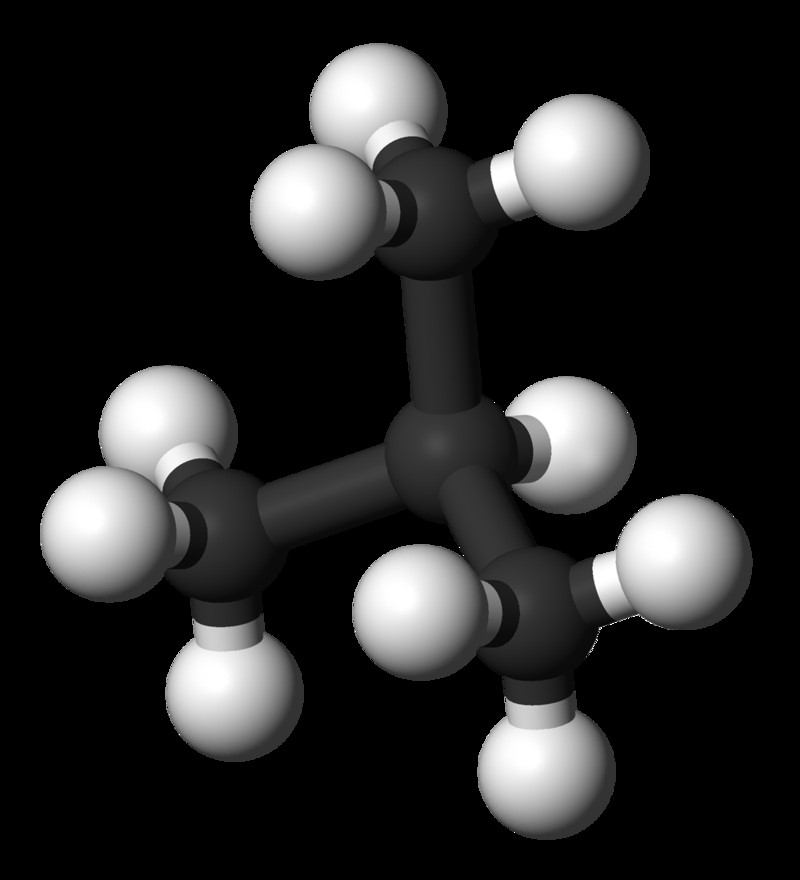
그림 02 :이소 부탄의 볼과 스틱 모델
isobutane은 정상 부탄보다 끓는점이 매우 낮습니다. 이소 부탄의 끓는점은 약 -11c입니다. 이 차이의 이유는 이소 부탄의 분지 구조 때문입니다. 선형 분자는 분자 분자보다 더 많은 반 데르 와알 힘을 가질 수있다. (선형 구조의 표면적은 분지 분자의 표면적보다 높기 때문에 분자 사이에 더 많은 반 데르 와알 힘을 가질 수 있습니다.) 약하거나 적은 양의 반 데르 와알 세력의 존재로 인해 분자를 서로 분리하는 것이 더 쉬워집니다. 따라서 끓는점이 감소합니다.
이소 부탄의 원자의 공간 배열의 차이로 인해 화학적 및 물리적 특성은 부탄의 특성과 다릅니다. 이소 부탄은 N- 부탄의 이성질체화로부터 형성 될 수있다. 촉매 반응이며 가역적입니다. 이 이성질체화는 올레핀이라는 중간체를 통해 수행됩니다. 프로세스의 효율은 시스템의 온도에 따라 다릅니다.
isobutane은 냉매로 사용됩니다. 오존층에 무시할만한 영향을 미치기 때문에 이소 부탄은 냉장고에 사용되는 클로로 플루오로 카본과 같은 화합물에 대한 좋은 치환기입니다.
.부탄과 이소 부탄의 유사성
- 부탄과 이소 부탄은 탄화수소 화합물입니다.
- 둘 다 동일한 화학적 공식을 가지고 있습니다.
- 둘 다 동일한 몰 질량을 가지고 있습니다.
- 두 화합물 모두 SP 하이브리드 화 된 탄소 원자로 구성됩니다.
- 둘 다 실온과 대기압에서 무색 가스입니다.
부탄과 이소 부탄의 차이
정의
부탄 : Butane은 이성질체로서 여러 형태로 발생할 수있는 탄화수소입니다.
이소 부탄 : 이소 부탄은 N- 부탄의 구조적 이성질체입니다.
화학 구조
부탄 : Butane은 선형 구조와 분기 구조의 혼합물입니다.
이소 부탄 : 이소 부탄은 본질적으로 분지 구조입니다.
비등점
부탄 : 부탄의 끓는점은 약 1c입니다.
이소 부탄 : 이소 부탄의 끓는점은 약 -11c.
입니다냄새
부탄 : 부탄은 휘발유와 같은 냄새가 있습니다.
이소 부탄 : 이소 부탄은 무취입니다.
결론
부탄과 이소 부탄은 원유에서 사소한 성분으로 발견 될 수있는 탄화수소 화합물입니다. 이들은 석유 정제의 파라핀 분획이라고 불리는 작은 알칸 화합물이다. 그것들은 동일한 화학적 공식과 동일한 몰 질량을 가지고 있지만 여러 가지 방법으로 다릅니다. 부탄과 이소 부탄의 주요 차이점은 부탄이 선형 또는 분지 분자 일 수 있지만 이소 부탄은 본질적으로 분지 분자라는 것입니다.
참조 :
1. "부탄 :정의, 속성 및 공식." Study.com, Study.com, 여기에서 구할 수 있습니다. 2017 년 8 월 23 일 액세스.
2. "Nist Chemistry Webbook, SRD 69." 국립 표준 기술 연구소 인 이소 부탄 (Isobutane). 2017 년 8 월 23 일 접근.
image courtesy
1. Ben Mills와 Jynto의“Isobutane-3D-Balls”-파일의 파생물 :Neopentane-3D-Balls.png 및 파일 :Methane-3D-Balls.png. (공개 도메인) Commons Wikimedia
2를 통한 (공개 도메인). Commons Wikimedia를 통한 "Isobutane-N-Butane"(Public Domain)







