주요 차이 - Butane vs Butene
butane and butene은 c와 h 원자로 만들어진 기체 화합물입니다. 그것들은 C 및 H 원자 만 존재하기 때문에 탄화수소라고합니다. 이들 분자는 분자 당 4 개의 탄소 원자로 구성된다. Butane과 Butene의 주요 공급원은 원유입니다. 따라서, 이들 가스는 석유 정제 공정의 부산물로 얻을 수있다. 그러나 그들은 원유에서 작은 치환기로 존재합니다. 이 가스는 가연성이기 때문에 연료로 사용될 수 있습니다. Butane 및 Butene의 완전한 연소는 열과 함께 이산화탄소 및 수증기를 생성합니다. 그러나 불완전한 연소는 이산화탄소 대신 일산화탄소를 생산하고 완전한 연소보다 적은 양의 열을 생성합니다. Butane과 Butene의 주요 차이점은 Butane 분자에는 이중 결합이 없지만 Butene 분자는 하나의 이중 결합을 가지고 있다는 것입니다.
주요 영역을 다루었습니다
1. 부탄이란?
- 정의, 속성 및 응용 프로그램
2. Butene
- 정의, 속성 및 응용 프로그램
3. Butane과 Butene 의 유사점은 무엇입니까?
- 일반적인 기능의 개요
4. Butane과 Butene의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :Butane, Butene, 연소, 원유, 탄화수소, 석유 
부탄이란 무엇입니까
butane은 화학식 c 4 를 갖는 탄화수소입니다. H 10 . 실온과 압력에서 무색 가스입니다. 이 화합물의 몰 질량은 약 58.12 g/mol입니다. 냄새와 같은 휘발유가 있습니다. 그것은 구조에 이중 결합이 없기 때문에 그룹 알칸에 속합니다. 부탄은 비극성 화합물입니다. 따라서, 그것은 극성 용매 또는 물에 용해되지 않습니다. 부탄 분자는 두 가지 다른 구조 이성질체에 존재할 수있다. 그것들은 n- 부탄과 이소 부탄입니다. N- 부탄은 부탄의 선형 직선 사슬 형태 인 반면 이소 부탄은 분지 구조입니다.
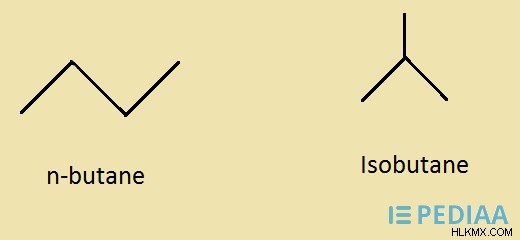
그림 1 :부탄의 구조 이성질체
butane은 매우 가연성입니다. 쉽게 액화됩니다. 부탄의 끓는점은 약 1C (또는 그 이하)이기 때문에이 부탄 액체는 실온에서 빠르게 기화됩니다. 주변에 충분한 산소가 존재하는 경우 Butane은 완전한 연소를 거쳐 열 에너지와 함께 이산화탄소 및 수증기를 형성 할 수 있습니다. 그러나 산소가 충분하지 않으면 부탄은 불완전한 연소를 겪어 일산화탄소와 탄소 먼지를 생성합니다.
휘발유의 기화를 고정시키기 위해 휘발유에 추가 할 수 있습니다. 이것은 부탄의 주요 용도 중 하나입니다. 부탄은 비극성이 높고 반응성이 적기 때문에 추출을위한 용매로 사용될 수있다. 또한 Butane은 소규모 응용 분야에서 연료로 사용됩니다.
Butene
butene은 화학식 c 4 를 갖는 탄화수소입니다. H 8 . 실온과 압력에서 무색 가스입니다. 약간 향기로운 냄새가납니다. Butene은 Alkene입니다. Butene의 주요 공급원은 원유입니다. Butene은 원유에 작은 성분으로 존재합니다. Butene은 여러 이성질체에서 찾을 수 있습니다. 그러나 Butene은 두 개의 탄소 원자 사이에 하나의 이중 결합을 갖습니다. Butene의 몰 질량은 약 56.11 g/mol.
입니다
그림 2 :Butene의 Cis-Trans Isomerism
Butene의 이성질체는 구조적 이성질체 또는 입체 소성기로 발생합니다. 이중 결합의 위치는 구조적 이성질체를 결정합니다. 1- 부틴은 탄소 사슬의 끝에서 이중 결합을 가지며, 2- 부틴은 탄소 사슬의 중간에 이중 결합을 갖는다. 또한, 분지 구조 이소 부틸렌은 선형 부전 분자의 또 다른 구조적 이성질체이다. 입체 소성기는 알릴 탄소 원자에서 알킬기의 위치의 차이에 따라 발생합니다. 이것을 기하학적 이성질체라고합니다.
butene은 석유 정제에서 생성됩니다. Butene의 생산은 균열 반응을 통해 수행됩니다. 이것은 장쇄 탄화수소가 작은 탄화수소 분자로 분해됩니다. Butene은 가연성 가스이며 연료로 사용될 수 있습니다. Butene은 중합체의 생산에서 중요한 단량체입니다. Butene에 존재하는 이중 결합은 중합을 겪을 수있게하여 결국 중합체 분자를 생성합니다.
Butane과 Butene의 유사성
- Butane과 Butene은 탄화수소입니다.
- 이들은 실온 및 압력에서 가스입니다.
- 둘 다 무색 가스입니다.
- Butane과 Butene은 석유 정제 과정에서 얻을 수 있습니다.
- 둘 다 가연성이 높습니다.
- 두 유형 모두 이성질체를 나타냅니다.
Butane과 Butene의 차이
정의
부탄 : Butane은 화학식 C 4 를 갖는 탄화수소입니다. H 10 .
butene : Butene은 화학식 C 4 를 갖는 탄화수소입니다. H 8 .
화학적 결합
부탄 : 부탄은 단일 채권 만 있습니다.
butene : Butene은 단일 채권뿐만 아니라 이중 채권을 가지고 있습니다.
분류
부탄 : 부탄은 알칸입니다.
butene : Butene은 Alkene입니다.
CIS- 트랜스 이성질체
부탄 : 부탄은 시스 트랜스 이성질체를 나타내지 않습니다.
butene : Butene은 시스 트랜스 이성질체를 보여줍니다.
몰 질량
부탄 : 부탄의 몰 질량은 58.12 g/mol.
입니다butene : Butene의 몰 질량은 약 56.11 g/mol.
입니다결론
butane 및 butene 가스는 연료로 사용될 수 있습니다. 이 가스는 화상을 입을 때 열을 발생시킵니다. 또한 Butane은 비극성 특성으로 인한 추출을위한 용매로 사용됩니다. Butene은 상이한 유형의 중합체의 생산을위한 단량체이다. Butene에 존재하는 이중 결합은 단량체로서 작용할 수있게한다. Butane과 Butene의 주요 차이점은 Butane 분자에는 이중 결합이 없지만 Butene 분자는 하나의 이중 결합을 가지고 있다는 것입니다.