어금니 질량은 물질의 물리적 특성입니다. 밀도, 융점, 끓는점 및 시스템에서 다른 물질과 반응하는 물질의 양과 같은 다른 물리적 및 화학적 특성을 분석, 비교 및 예측하는 데 매우 유용합니다. 몰 질량을 계산하는 방법이 하나 이상 있습니다. 이러한 방법 중 일부에는 직접 방정식 사용, 화합물에 다른 요소의 원자 질량을 추가하고 끓는점 높이 또는 동결 지점 우울증을 사용하는 것이 포함됩니다. 이러한 주요 방법 중 일부는이 기사에서 간결하게 논의 될 것입니다.
주요 영역을 다루었습니다
1. 어금니 질량
- 정의, 계산 방정식, 설명
2. 어금니 질량을 찾는 방법
- 몰 질량을 결정하는 방법
3. 물질의 어금니 질량을 아는 것의 중요성
- 어금니 질량의 적용
주요 용어 :Avogadro의 숫자, 끓는점, Calusius-clapeyron, calusius-clapeyron, cryoscopic constant, ebullioscopic constant, freezing point, molality, molar mass, 분자량, 삼투압, 상대적 원자 질량

어금니 질량
어금니 질량은 특정 물질의 두더지의 질량입니다. 물질의 어금니 질량에 가장 일반적으로 사용되는 단위는 GMOL입니다. 그러나, 몰 질량에 대한 SI 단위는 kgmol (또는 kg/mol)이다. 어금니 질량은 다음 방정식을 사용하여 계산할 수 있습니다.
어금니 질량 =물질의 질량 (kg)/물질의 양 (mol)
두더지 또는 mol은 물질의 양을 측정하는 데 사용되는 단위입니다. 물질의 한 몰은 물질이 만들어지는 매우 많은 수, 6.023 x 10의 원자 (또는 분자)와 같습니다. 이 번호를 Avogadro의 번호라고합니다. 원자의 유형이 무엇이든, 그것의 한 몰은 그 양의 원자 (또는 분자)와 같기 때문에 일정합니다. 따라서, 몰 질량은 새로운 정의, 즉 몰 질량은 특정 물질의 총 질량 (또는 분자)의 총 질량이다. 혼란을 피하려면 다음 예를 살펴보십시오.
- 화합물 A는 분자로 구성됩니다.
- 화합물 B는 B 분자로 구성됩니다.
- 한 두더지의 화합물 A는 분자의 6.023 x 10으로 구성됩니다.
- 1 몰의 화합물 B는 6.023 x 10의 B 분자로 구성됩니다.
- 화합물 A의 몰 질량 A는 6.023 x 10의 질량의 합입니다.
- 화합물 B의 몰 질량 B.
이제 우리는 이것을 실제 물질에 적용 할 수 있습니다. h 2 의 1 몰 O는 6.023 x 10 h 2 로 구성됩니다 o 분자. 총 질량은 6.023 x 10 h 2 입니다 o 분자는 약 18 g이다. 따라서, H 2 의 몰 질량 O는 18 g/mol입니다.
어금니 질량을 찾는 방법
물질의 몰 질량은;
와 같은 여러 방법을 사용하여 계산할 수 있습니다.- 원자 질량 사용
- 어금니 질량을 계산하기위한 방정식 사용 끓는점에서
- 동결 지점 우울증에서
- 삼투압에서
이 방법은 아래에서 자세히 설명합니다.
원자 질량 사용
분자의 몰 질량은 원자 질량을 사용하여 결정될 수 있습니다. 이것은 존재하는 각 원자의 어금니 질량을 첨가하여 수행 할 수 있습니다. 요소의 어금니 질량은 다음과 같습니다.
요소의 어금니 질량 =상대 원자 질량 x 몰 질량 상수 (g/mol)
상대 원자 질량은 Carbon-12 원자의 질량에 비해 원자의 질량이며 단위가 없습니다. 이 관계는 다음과 같이 주어질 수 있습니다.
a =a/ [Carbon-12 Atom x (1/12)의 질량 1의 질량의 질량
이 기술을 이해하려면 다음 예를 고려해 봅시다. 다음은 동일한 원자를 가진 화합물, 여러 다른 원자의 조합 및 다수의 원자의 조합에 대한 계산입니다.
• h 2의 몰 질량
o 존재하는 원자의 유형 =2 h 원자
o 상대 원자 질량 =1.00794 (h)
o 각 원자의 몰 질량 =1.00794 g /mol (h)
o 화합물의 몰 질량 =(2 x 1.00794) g /mol
=2.01588 g /p>
• HCl의 몰 질량
O가 존재하는 원자의 유형 =1 H 원자 및 하나의 Cl 원자
o 상대 원자 질량 =1.00794 (h) + 35.453 (cl)
o 각 원자의 몰 질량 =1.00794 g /mol (h) + 35.453 g /mol (cl)
o 화합물의 어금니 질량) + (1 x 35.453) + (1 x 3.453) + (1 x 3.453). /> =36.46094 g/mol
• C 6의 몰 질량 H 12 o 6
O가 존재하는 원자의 유형 =6 C 원자, 12 시간 원자 및 6 O Cl 원자
o 상대 원자 질량 =12.0107 (c) + 1.00794 (h) + 15.999 (o)
o 각 원자의 몰 질량 =12.0107 g /mol + 1.00794 g /mol (h) + 15.1
. (6 x 12.0107) + (12 x 1.00794) + (6 x 15.999) g/mol
=180.15348 g/mol
방정식 사용
어금니 질량은 아래 주어진 방정식을 사용하여 계산할 수 있습니다. 이 방정식은 알려지지 않은 화합물을 결정하는 데 사용됩니다. 다음 예를 고려하십시오.
Molar Mass =물질의 질량 (kg)/물질의 양 (mol)
- 화합물 D는 용액에있다. 세부 사항은 다음과 같이 제공됩니다.
- 화합물 D는 강력한 기초입니다.
- 분자 당 하나의 이온을 방출 할 수 있습니다.
- 화합물 D의 용액은 0.599g의 화합물 D를 사용하여 만들어졌다.
- 1 :1 의 비율로 HCL과 반응합니다.
그러면 결정은 산베이스 적정에 의해 수행 될 수 있습니다. 그것은 강한 염기이기 때문에 페놀프탈레인 지표의 존재하에 강산 (예 :HCl, 1.0 mol/L)으로 용액을 적정하십시오. 색상 변화는 적정의 종말점 (예 :15.00ml의 HCL이 첨가 될 때)을 나타내며, 이제 알려지지 않은 염기의 모든 분자는 첨가 된 산으로 적정합니다. 그런 다음 미지의 화합물의 몰 질량은 다음과 같이 결정될 수 있습니다.
o 산의 양 반응의 양 =1.0 mol /l x 15.00 x 10-3 l
=1.5 x 10-2 mol
o 따라서, 기본 반응의 양 =1.5 x 10-2 mol
o 화합물 d =0.599 g /1.5 x 10-2 mol
=39. Naoh로 예측됩니다. (그러나 이것을 확인하기 위해서는 추가 분석을 수행해야합니다.
비등점 고도에서
끓는점 고도는 순수한 용매에 화합물을 첨가하면 순수한 용매보다 높은 비등점으로 그 혼합물의 끓는점을 증가시킬 것이라고 설명하는 현상입니다. 따라서, 첨가 된 화합물의 몰 질량은 두 끓는점 사이의 온도 차이를 사용하여 발견 될 수있다. 순수한 용매의 끓는점이 t 용매 인 경우 용액의 끓는점 (첨가 된 화합물 포함)은 t 용액 입니다. , 두 끓는점의 차이는 다음과 같이 주어질 수 있습니다.
Δt =t 솔루션 - t 용매
Clausius-Clapeyron 관계와 Raoult의 법칙을 사용하여 솔루션의 ΔT와 몰 사이의 관계를 얻을 수 있습니다.
Δt =k b . m
여기서 k b ebullioscopic 상수이며 용매의 특성에만 의존하고 m은 molality
입니다.위의 방정식에서, 우리는 용액의 몰 리이트에 대한 값을 얻을 수 있습니다. 이 용액의 제조에 사용 된 용매의 양이 알려져 있으므로 첨가 된 화합물의 두더지 값을 찾을 수 있습니다.
molality =첨가 된 화합물의 두더지 (mol)/순수한 용매의 질량 (kg)
이제 우리는 용액의 화합물의 두더지와 추가 된 화합물의 질량을 알기 때문에 화합물의 몰 질량을 결정할 수 있습니다.
Molar mass =화합물의 질량 (g)/Moles of Compound (mol)
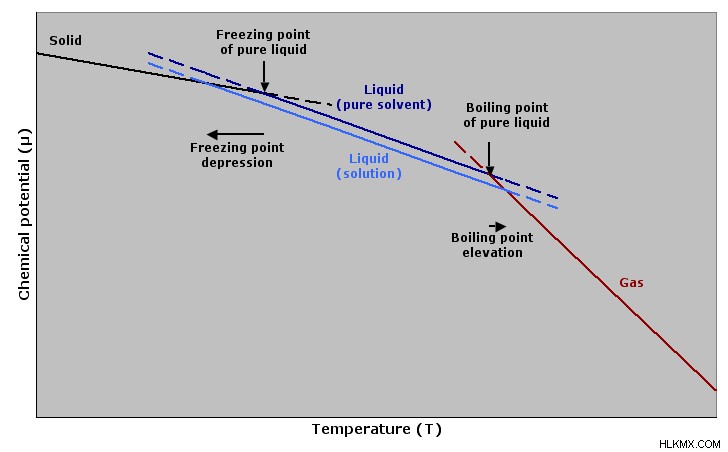
그림 01 :끓는점 고도 및 동결 지점 우울증
동결 지점 우울증에서.
동결 지점 우울증은 끓는점 높이와 반대입니다. 때때로, 화합물이 용매에 첨가 될 때, 용액의 동결점은 순수한 용매의 것보다 낮아진다. 위의 방정식은 약간 수정되었습니다.
Δt =t 솔루션 - t 용매
Δt 값은 비등점이 초기 값보다 낮기 때문에 값 마이너스 값입니다. 용액의 몰은 끓는점 상승 방법과 동일하게 얻을 수 있습니다.
Δt =k f . m
여기서 k f Cryoscopic 상수라고합니다. 그것은 용매의 특성에만 의존합니다.
나머지 계산은 끓는점 고도 방법과 동일합니다. 여기에서 첨가 된 화합물의 두더지는 아래 방정식을 사용하여 계산할 수 있습니다.
molality =Moles of 화합물 (mol)/ 사용 된 용매의 질량 (kg)
그러면 어금니 질량은 첨가 된 화합물의 값과 화합물의 질량을 사용하여 계산할 수 있습니다.
Molar mass =화합물의 질량 (g)/Moles of Compound (mol)
삼투압에서삼투압은 삼투에 의해 순수한 용매가 주어진 솔루션으로 통과하는 것을 피하기 위해 적용 해야하는 압력입니다. 삼투압은 아래 방정식에서 주어질 수 있습니다.
∏ =mrt
여기서, 여기서, ∏는 삼투압,
m은 용액의 어금니
r입니다.
솔루션의 어금니는 다음 방정식에 의해 제공됩니다.
Molarity =Moles of Compound (mol) / 용액의 부피 (l)
솔루션의 볼륨을 측정 할 수 있고 어금니는 위와 같이 계산 될 수 있습니다. 따라서, 용액 내 화합물의 두더지를 측정 할 수있다. 그런 다음 어금니 질량을 결정할 수 있습니다.
Molar mass =화합물의 질량 (g)/Moles of Compound (mol)
물질의 몰 질량을 아는 것이 중요하다
- 다른 화합물의 어금니 질량은 해당 화합물의 용융점과 끓는점을 비교하는 데 사용될 수 있습니다.
- 어금니 질량은 화합물에 존재하는 원자의 질량 백분율을 결정하는 데 사용됩니다.
- 어금니 질량은 화학 반응에서 매우 중요합니다.
- 실험 설정이 설계되기 전에 어금니 질량을 아는 것은 매우 중요합니다.
요약
주어진 화합물의 몰 질량을 계산하는 몇 가지 방법이 있습니다. 그들 중에서 가장 쉬운 방법은 해당 화합물에 존재하는 어금니 질량을 첨가하는 것입니다.