주요 차이 - 페놀 대 벤조산
페놀과 벤조산은 유기 화합물입니다. 둘 다 방향족 화합물입니다. 방향족 화합물은 분비 된 PI 전자 구름이있는 평면 고리 시스템으로 구성된 물질입니다. 페놀은 가장 간단한 방향족 알코올입니다. 독성 화합물로 간주됩니다. 벤조산은 가장 간단한 방향족 카르 복실 산입니다. 독성 화합물로 간주되지 않습니다. 이들 화합물은 치환 된 벤젠 고리로 구성된다. 페놀과 벤조산의 주요 차이점은 페놀이 알코올이고 벤조산은 카르 복실 산이라는 것입니다.
주요 영역을 다루었습니다
1. 페놀이란?
- 정의, 구조, 반응, 사용
2. 벤조산이란?
- 정의, 구조, 사용
3. 페놀과 벤조산의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 페놀과 벤조산의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :알코올, 방향족 화합물, 벤젠 고리, 벤조산, 카르 복실 산, 페놀

페놀이란 무엇입니까
페놀은 가장 간단한 방향족 알코올입니다. 페놀의 분자식은 C 6 이다 h 5 오. 그것은 페놀 분자가 –oh 그룹으로 대체 된 벤젠 고리로 구성되어 있음을 나타냅니다. 하나의 페놀 분자에는 하나의 –oh 그룹이 포함됩니다. 페놀의 몰 질량은 약 94.11 g/mol.
이다페놀은 실온과 압력에서 투명한 결정질 고체로 나타납니다. 달콤한 냄새가납니다. 이 고체의 융점은 약 40.5 ° C입니다. 페놀의 끓는점은 약 181.7 ° C입니다. 상업적으로 이용 가능한 페놀은 고체 건조 분말 형태 또는 액체 형태 일 수있다. 페놀은 물로 오해가 있습니다. -OH 그룹은 물 분자와 수소 결합을 형성 할 수 있기 때문입니다.
페놀은 약산입니다. 그것은 부분적으로 페놀 레이트 음이온으로 분리되어 히드로 늄 양이온을 형성 할 수있다. 그러나 지방족 알코올과 비교할 때 더 산성입니다. 이러한 증가 된 산도는 페놀의 공명 안정화의 결과입니다. 여기서, H 이온을 방출 한 후 형성되는 페녹 시드 음이온은 산소 원자에 대한 음전하의 비편성에 의해 안정화된다.
.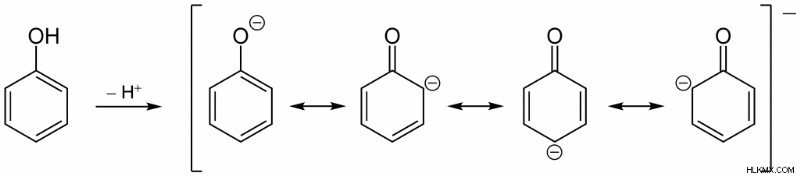
그림 1 :페녹 시드 음이온의 공명 안정화
페놀은 독성이 높은 화합물로 간주됩니다. 페놀 증기는 눈과 피부에 부식성이 있습니다. 산소 원자의 PI 전자가 벤젠 고리에 비편화 될 수 있기 때문에 페놀 분자는 전자 성 방향족 치환을 겪을 수있다. 그런 다음 electrophiles는 고리와 결합 할 수 있습니다.
페놀은 플라스틱 생산을위한 선구자로 사용됩니다. 그 외에도 일반적으로 방부제 및 소독제로 사용됩니다. 페놀은 화장품 및 약물 생산에도 사용됩니다 (의학).
벤조 산
벤조산은 가장 간단한 방향족 카르 복실 산입니다. 벤조산의 분자식은 C <서브> 6 이다 h 5 쿠. 벤조산의 몰 질량은 약 122.12 g/mol입니다. 하나의 벤조산 분자는 카르 복실 산기 (-COOH)로 치환 된 벤젠 고리로 구성된다.
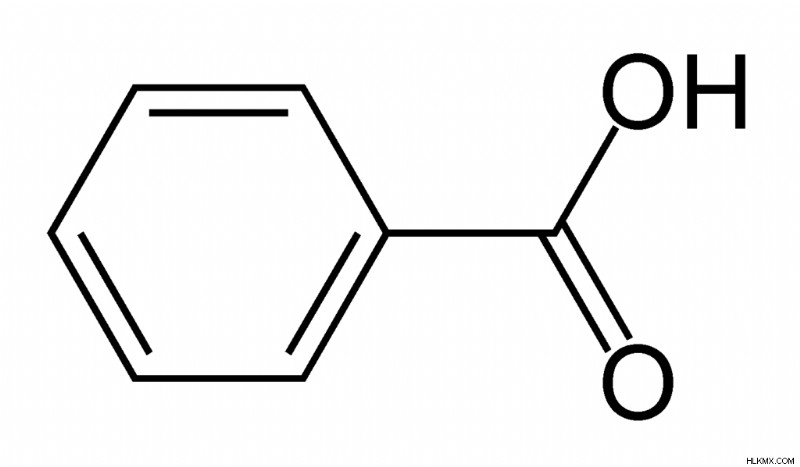
그림 2 :벤조산의 화학 구조
실온과 압력에서 벤조산은 백색 결정질입니다. 물에 약간 용해됩니다. 벤조산은 쾌적한 냄새가납니다. 벤조산 고체의 융점은 약 122.41 ℃이다. 벤조산의 끓는점은 249.2 ° C로 제공됩니다. 그러나 370 ° C에서 분해됩니다.
벤조산은 카르 복실 그룹의 전자 철수 특성으로 인해 전자 성 방향족 치환을 겪을 수 있습니다. 카르 복실 산은 PI 전자와 방향족 고리를 제공 할 수 있습니다. 그런 다음 전자가 풍부하게됩니다. 따라서 전기성은 방향족 고리와 반응 할 수 있습니다.
벤조산은 식품 방부제로 널리 사용되는 진균 화합물입니다. 이것은 음식이 곰팡이 성장을 방지 할 수 있음을 의미합니다. 벤조산은 딸기와 같은 과일에서 자연적으로 발견 될 수 있습니다.
페놀과 벤조산의 유사성
- 둘 다 유기 화합물입니다.
- 둘 다 방향족 물질입니다.
- 둘 다 전자 성 방향족 치환 반응을 겪을 수 있습니다
- 둘 다 실온 및 압력에서 무색 또는 흰색 결정입니다.
페놀과 벤조산의 차이
정의
페놀 : 페놀은 가장 간단한 방향족 알코올입니다.
벤조산 : 벤조산은 가장 간단한 방향족 카르 복실 산입니다.
분자식
페놀 : 페놀의 분자식은 C 6 이다 h 5 오.
벤조산 : 벤조산의 분자식은 C <서브> 6 이다 h 5 COOH.
몰 질량
페놀 : 페놀의 몰 질량은 약 94.11 g/mol.
이다벤조산 : 벤조산의 몰 질량은 약 122.12 g/mol입니다.
치환
페놀 : 페놀은 –OH 치환 벤젠 고리를 가지고있다.
벤조산 : 벤조산에는 –cooh 치환 된 벤젠 고리가 있습니다.
용융점
페놀 : 페놀의 용융점은 약 40.5 ° C입니다.
벤조산 : 벤조산의 융점은 약 122.41 ° C입니다.
비등점
페놀 : 페놀의 끓는점은 약 181.7 ° C입니다.
벤조산 : 벤조산의 끓는점은 249.2 ° C로 제공됩니다.
수용성
페놀 : 페놀은 물로 오해가 있습니다.
벤조산 : 벤조산은 물에 약간 용해됩니다.
결론
페놀과 벤조산은 유리한 화학적 및 물리적 특성으로 인해 널리 사용되는 유기 화합물 중 하나입니다. 페놀은 독성 화합물로 간주되지만 일부 제품의 성분으로 사용됩니다. 벤조산은 일부 과일에서 자연적으로 발견 될 수 있습니다. 페놀과 벤조산의 주요 차이점은 페놀은 알코올이고 벤조산은 카르 복실 산이라는 것입니다.