주요 차이 - Daniell Cell vs Galvanic Cell
전기 화학 셀은 화학 반응으로 전기를 생성하거나 전기와의 화학 반응을 촉진 할 수있는 장치입니다. 이들 세포는 2 개의 절반 세포로 구성된다. 절반 셀당 전극과 전해질이 있습니다. 때때로 두 전극은 동일한 용기에 배치되지만 두 전해질은 다공성 장벽을 통해 분리됩니다. Daniell 세포와 갈바니 세포는 전기 화학 세포의 예입니다. Daniell 세포는 구리 및 아연 전극으로 구성된 전기 화학적 세포의 한 유형입니다. 갈바닉 세포는 자발적인 산화 환원 반응에 의해 생성 된 전기 에너지를 사용하는 전기 화학적 세포입니다. Daniell Cell과 Galvanic Cell의 주요 차이점은 Daniell 세포는 구리와 아연만을 전극으로 사용하는 반면 갈바니 셀은 전극으로 다양한 금속을 가질 수 있다는 것입니다.
주요 영역을 다루었습니다
1. Daniell 세포는 무엇입니까
- 정의, 작동 방식
2. 갈바닉 세포는 무엇입니까
- 정의, 작동 방식
3. Daniell Cell과 Galvanic Cell의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. Daniell Cell과 Galvanic Cell의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :구리, 다니엘 세포, 전기 화학 세포, 전극, 전해질, 갈바니 세포, 반 세포, 산화, 산화 환원 반응, 감소, 볼타 세포, 아연

Daniell Cell
란?Daniell Cell은 구리 (II) 설페이트 및 아연 황산염에 각각 침지 된 구리 전극 및 아연 전극으로 구성된 전기 화학적 세포의 한 유형입니다. 따라서이 셀은 두 개의 전해질을 사용합니다. 전해질은 물에 용해 될 때 이온으로 분리 될 수있는 물질입니다. 이 이온은 그 물질의 수용액을 통해 전기를 전도 할 수 있습니다.
Daniell 세포의 절반 세포는 구리 (II) 설페이트 용액에 담긴 구리 전극으로 구성되며, 다른 절반 세포는 아연 설페이트 용액에 침지 된 아연 전극으로 구성됩니다. 전기 전도성을위한 전자를 제공하는 산화 환원 반응이 있습니다. 아연은 양극으로 사용됩니다. 구리는 음극입니다. 두 개의 절반 반응은 다음과 같습니다.
anode :zn (s) → zn (aq) +2e
cathode :cu (aq) + 2e → Cu (s)
양극에서 아연은 아연 (ii) 이온으로 산화됩니다. 캐소드에서, 구리 (II) 이온이 구리로 감소된다. 총 반응은 다음과 같이 주어질 수 있습니다.
zn (s) +cu (aq) → zn (aq) +cu (s)
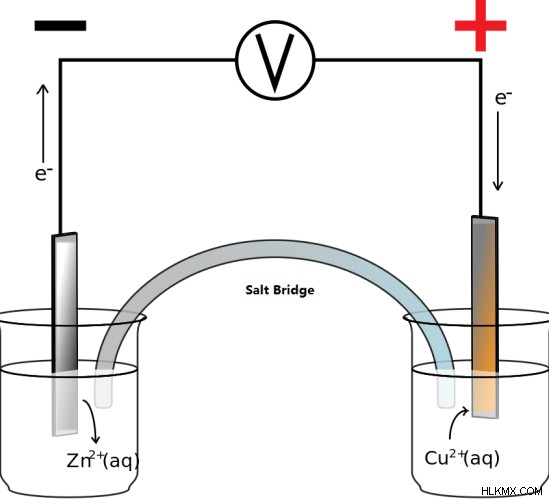
그림 1 :Daniell Cell의 개략도
셀의 쉬운 데모를 위해 두 전해질이 서로 분리되고 소금 브리지가 이온의 움직임에 사용됩니다. 소금 다리는 세포에서 발생하는 산화 환원 반응을 방해하지 않는 화합물로 채워진다. 그러나 실제 Daniell 세포에서, 다공성 장벽은 2 개의 전해 용액을 분리하는 데 사용됩니다. 이 다공성 장벽은 구리 이온의 황산 아연으로의 움직임을 제어 할 수 없으며 그 반대도 마찬가지입니다. 이로 인해 재충전이 불가능합니다.
Galvanic Cell
Galvanic Cell은 자발적인 산화 환원 반응을 사용하여 전기 에너지를 생성하는 전기 화학 셀의 한 유형입니다. 이것을 볼타 셀 라고도합니다 . 세포는 2 개의 절반 세포로 구성됩니다. 각각의 절반 세포는 전극과 전해질로 구성된다. 전극은 전해 용액에 침지된다. 때때로 이러한 전해질은 완전히 분리되어 있지만 다른 경우에는 다공성 장벽에 의해서만 분리됩니다. 전해질이 완전히 분리되면 소금 브리지는 두 전해질 사이의 이온의 움직임을 유지하는 데 사용됩니다.
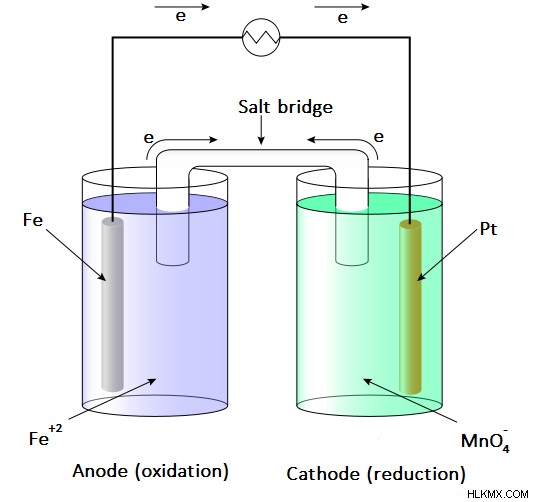
그림 2 :갈바니 세포의 예
전극과 전해질은 자발적인지 아닌지를 고려하여 선택됩니다. 이것은 각 절반 셀의 전극 전위를 계산하여 이론적으로 발견 될 수 있습니다. 그러나, 한 절반 세포는 산화를 나타내야하는 반면, 다른 절반 세포는 환원 반응을 보인다. 산화는 양극에서 발생하는 반면, 음극에서 감소가 발생합니다. 갈바닉 (Voltaic) 세포는 자발적인 산화 환원 반응 동안 방출 된 에너지를 사용하여 전기를 생성하므로 갈바닉 세포는 전기 에너지의 공급원으로 사용됩니다. 그들은 직류를 생산합니다.
Daniell Cell과 Galvanic Cell의 유사성
- 둘 다 전해 세포의 예입니다.
- 둘 다 전극과 전해질로 구성된 절반 세포로 구성됩니다.
- 전해질은 다공성 막에 의해 완전히 분리되거나 분리 될 수 있습니다.
Daniell Cell과 Galvanic Cell의 차이
정의
Daniell Cell : Daniell 세포는 구리 전극 및 구리 (II) 설페이트 및 아연 황산 아연에 각각 침지 된 아연 전극으로 구성된 전기 화학적 세포의 한 유형입니다.
.Galvanic Cell : 갈바닉 세포
양극
Daniell Cell : Daniell 세포의 양극은 아연 전극입니다.
Galvanic Cell : 갈바닉 세포의 양극은 산화 될 수있는 금속입니다.
음극
Daniell Cell : Daniell 세포의 음극은 구리 전극입니다.
Galvanic Cell : 갈바닉 세포의 음극은 감소 될 수있는 금속입니다.
전해질
Daniell Cell : 다니엘 세포에 사용되는 전해질은 구리 (II) 설페이트 및 아연 황산 아연입니다.
Galvanic Cell : 갈바닉 세포에 사용되는 전해질은 각 전극의 금속의 염입니다.
결론
daniell 세포와 갈바니 세포는 전기 화학적 세포입니다. 이들 세포는 전기 에너지 생성에 자발적 산화 환원 반응을 사용한다. 이 생성 된 에너지는 외부 작업을 수행하기 위해 사용될 수 있습니다. Daniell Cell과 Galvanic Cell의 주요 차이점은 Daniell 세포가 구리와 아연만을 전극으로 사용하는 반면 갈바니 셀은 전극으로 다양한 금속을 가질 수 있다는 것입니다.
.