주요 차이 - 원자가 전자 대 유리 전자
원자는 세 가지 유형의 아 원자 입자, 즉 전자, 양성자 및 중성자로 구성됩니다. 양성자와 중성자는 원자의 핵에 있습니다. 전자는 핵 외부에 있습니다. 이 전자는 특정 거리에서 핵 주위에서 연속적인 움직임에 있습니다. 이들 전자가 들어가는 경로를 전자 껍질 또는 궤도라고한다. 하나의 원자는 하나 이상의 궤도를 가질 수 있습니다. 원자가 전자는 원자의 가장 바깥 쪽 궤도에서 발견 될 수있는 전자입니다. 유리 전자는 원자에 결합되지 않습니다. 이 전자는 격자 구조에서 찾을 수 있습니다. 그들은 격자 안에서 자유로운 움직임을하고 있습니다. 원자가 전자와 자유 전자의 주요 차이점은 전자의 수는 원소 특성이고 자유 전자의 수는 격자 특성이라는 것입니다.
주요 영역을 다루었습니다
1. 원자가 전자
- 정의, 예제, 산화 상태에 미치는 영향
2. 자유 전자 란?
- 정의, 발생
3. 원자가 전자와 자유 전자의 차이점은 무엇입니까
- 주요 차이점 비교
주요 용어 :원자, 원자 번호, 전자, 자유 전자, 격자, 금속, 중성자, 핵, 궤도, 양성자, 원자가 전자

원자가 전자
원자가 전자는 원자의 가장 바깥 쪽 궤도에 존재하는 전자입니다. 이들은 원자의 핵에 대한 인력이 가장 적은 전자입니다. 원자가 전자가 해당 원자의 다른 전자보다 장거리에 있기 때문입니다.
원자가 전자는 원자의 화학 반응과 화학적 결합을 담당합니다. 원자가 전자와 원자의 핵 사이의 인력은 적기 때문에, 원자가 전자는 쉽게 제거 될 수있다 (내부 궤도의 전자보다). 이것은 이온 성 화합물 및 공유 화합물의 형성에서 중요하다. 원자가 전자를 잃어 버리면 원자가 양이온을 형성 할 수 있습니다. 다른 원자의 원자가 전자와 원자의 원자가 전자 공유 공유 결합을 형성합니다.
|
주기 테이블의 그룹
|
원자가 전자 수
|
|
그룹 1 (예 :Na, K)
|
1
|
|
그룹 2 (예 :Ca, Mg)
|
2
|
|
그룹 13 (예 :B, al)
|
3
|
|
그룹 14 (예 :C, Si)
|
4
|
|
그룹 15 (예 :n, p)
|
5
|
|
그룹 16 (예 :O, S)
|
6
|
|
그룹 17 (예 :F, Cl)
|
7
|
|
그룹 18 (예 :He, NE)
|
8
|
s 블록 요소와 p 블록 요소의 경우 원자가 전자는 가장 바깥 쪽 궤도에 있습니다. 그러나 전이 요소의 경우, 원자가 전자는 내부 궤도에도 존재할 수있다. 이는 하위 orbitals 간의 에너지 차이 때문입니다. 예를 들어, 망간 (MN)의 원자 수는 25입니다. 코발트의 전자 구성은 [ar] 3d4s입니다. 코발트의 원자가 전자는 4S 궤도에 있어야합니다. 그러나 Mn에는 7 개의 원자가 전자가 있습니다. 3D 궤도의 전자는 3D 궤도가 4S 궤도 외부에 있기 때문에 원자가 전자로 간주됩니다 (3D의 에너지는 4S 궤도보다 높음)
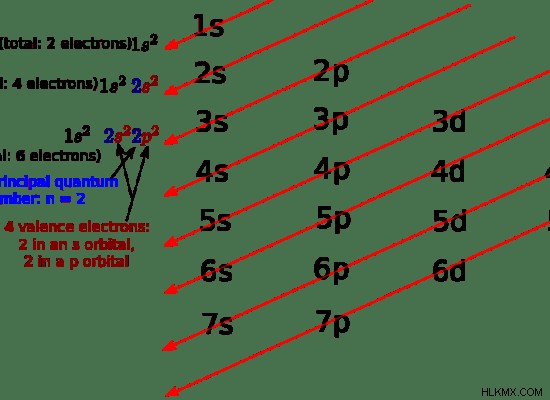
그림 1 :탄소의 원자가 전자
원자의 산화 상태는 그 원자의 원자가 전자에 따라 다릅니다. 일부 원자는 안정화되기 위해 원자가 전자를 제거합니다. 그런 다음 해당 원자의 산화 상태가 증가합니다. 일부 원자는 가장 바깥 쪽 궤도에서 더 많은 전자를 얻습니다. 그런 다음 해당 원자의 원자가 전자의 수가 증가합니다. 원자의 산화 상태를 감소시킵니다.
자유 전자
자유 전자는 원자에 부착되지 않은 전자입니다. 자유 전자는 어디에서나 찾을 수 없습니다. 고독한 전자가 매우 반응하고 무엇이든 반응 할 수 있기 때문입니다. 그러나 결정 구조와 금속에서는 자유 전자가 발견 될 수 있습니다.
자유 전자는 격자의 비편정 전자입니다. 결정 구조에서, 일부 전자는 결정 결함으로 인해 그 자리에 남아 있지 않습니다. 그들은 격자 내부의 어느 곳에서나 움직일 수있는 자유 전자가됩니다. 이 전자는 열과 전기의 전도를 담당합니다.
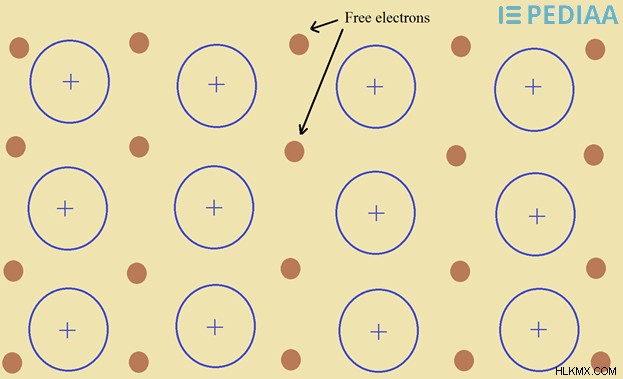
그림 2 :금속 격자의 자유 전자
금속에는 금속 이온 사이에 자유 전자가 있습니다. 유리 전자의 바다에서 금속 이온의 격자입니다. 이 유리 전자는 금속을 통해 열과 전기를 전도 할 수 있습니다. 이 자유 전자는 금속을 통해 전류를 전도 할 수 있습니다.
원자가 전자와 자유 전자의 차이
정의
원자가 전자 : 원자가 전자는 원자의 가장 바깥 쪽 궤도에 존재하는 전자입니다.
프리 전자 : 자유 전자는 원자에 부착되지 않은 전자입니다.
핵에 대한 매력
원자가 전자 : 원자가 전자는 원자의 핵에 대한 인력이 적습니다.
프리 전자 : 자유 전자는 원자의 핵을 향한 매력이 없습니다.
화학적 결합
원자가 전자 : 원자가 전자는 원자의 화학적 결합을 담당합니다.
프리 전자 : 유리 전자는 화학 결합에 관여하지 않습니다.
열과 전기의 전도
원자가 전자 : 원자가 전자는 열과 전기를 전도 할 수 없습니다.
프리 전자 : 자유 전자는 열과 전기의 전도를 담당합니다.
자연
원자가 전자 : 원자가 전자의 수는 원소 특성입니다.
프리 전자 : 자유 전자의 수는 격자 특성입니다.
결론
원자가 전자는 원자에 느슨하게 결합 된 전자입니다. 유리 전자는 모든 원자에 완전히 바지가 없습니다. 원자가 전자는 원자의 화학 반응 및 화학적 결합을 담당합니다. 자유 전자는 격자 구조의 열 및 전기 전도에 참여합니다. 원자가 전자와 자유 전자 사이에는 많은 차이가 있습니다. 주요 차이점은 전자의 수가 원소 특성이고 자유 전자의 수는 격자 속성이라는 것입니다.