주요 차이 - 산화 질소 대 아산화 질소 (웃음 가스)
산화 질소와 아산화 질소는 질소의 산화물입니다. 질소는 원자 번호 7을 갖는 화학 요소이며,주기적인 요소 테이블의 p 블록에서 비금속입니다. 다른 산화물의 질소는 산화 상태가 다릅니다. 산화 상태는 특정 원자가 다른 원자와 잃어버린 전자의 수입니다. 산화 질소에서, 질소 원자는 산소 원자와 함께 2 개의 전자를 공유한다. 따라서 산화 질소에서 질소의 산화 상태는 +2입니다. 대조적으로, 아산화 질소에서 질소의 산화 상태는 +1 입니다. . 이것은 산화 질소와 아산화 질소의 주요 차이점입니다.
주요 영역을 다루었습니다
1. 산화 질소
- 정의, 화학적 특성, 반응
2. 아산화 질소 (웃음 가스)
- 정의, 화학적 특성, 반응
3. 산화 질소와 아산화 질소의 유사점은 무엇입니까
- 일반적인 기능의 개요
4. 산화 질소와 아산화 질소의 차이는 무엇입니까
- 주요 차이점 비교
핵심 용어 :원자력, 원자 수, 일산화염, 산화 질소, 산화 질소, 질소 산화물, 산화 상태, 산소

산화 질소
산화 질소는 화학적 공식을 갖는 질소의 산화물입니다. 여기서, 하나의 질소 원자는 공유 결합을 통해 산소 원자에 결합된다. 이것은 질소 원자와 산소 원자가 짝을 이루지 않은 전자를 공유한다는 것을 의미합니다. 실온과 압력에서 산화 질소는 독성이 있고 무색 가스입니다.

그림 1 :산화 질소의 루이스 도트 구조
이 화합물의 몰 질량은 30 g/mol입니다. 산화 질소의 융점은 -164 ° C이고 끓는점은 -152 ° C입니다. 산화 질소 분자는 서로 결합 된 원자가 두 개만 있기 때문에 선형 모양을 갖는다. 질소와 산소의 짝을 이루지 않은 전자가 공유 될 때, 질소 원자에 다른 짝을 이루지 않은 전자가 있습니다. 그러나 공유 할 산소 원자에는 다른 짝을 이루지 않은 전자가 없습니다. 그런 다음 짝을 이루지 않은 전자는 두 원자 사이에서 단독으로 공유됩니다. 따라서, 공유 결합의 실제 구조는 이중 결합과 트리플 결합 사이입니다. 그런 다음 결합 길이는 오후 115시이며, 이는 예상 값 인 두 원자 사이의 더 먼 거리입니다.

그림 2 :산화 질소의 질소와 산소 사이의 실제 결합
산화 질소는 산소의 존재하에 이산화 질소를 형성 할 수 있습니다. 그러나 물에서 산화 질소는 산소 및 H 2 와 반응합니다. o 아질산을 형성하기 위해 (hno 2 ). 이 가스가 냉각되면 산화 질소 이량 체를 형성합니다 (n 2 . o 2 ). 이것들은 산화 질소의 주요 반응입니다.
산화 질소에서 질소의 산화 상태는 +2입니다. 즉, 산소의 산화 상태는 -2이고 아산화 질소 분자는 중성 화합물이기 때문에 질소의 산화 상태는 +2이어야합니다.
.아산화 질소 (웃음 가스)
아산화 질소는 화학적 공식을 가진 질소의 산화물입니다. n 2 O. 아산화 질소의 IUPAC 이름은 Dinitrogen monoxide 입니다. . 이 가스는 웃음 가스 라고도합니다 그것은 가벼운 히스테리에 의해 진행되는 통증에 무감각을 유발하기 때문에 때로는 웃음이 있습니다.
이 가스의 몰 질량은 44 g/mol입니다. 실온과 압력에서 무색 가스입니다. 산화 질소의 융점은 -90.86 ° C이고, 비등점은 -88.48 ° C입니다. n 2 o 분자는 2 개의 질소 원자와 산소 원자로 구성된다. 질소 원자는 서로 결합되고, 산소 원자는 2 개의 질소 원자 중 하나에 결합된다. 이들 원자 사이의 화학적 결합이 고려되면, n < 2 o 공명을 보여줍니다. 이 분자에는 두 가지 주요 공명 구조가 있습니다.

그림 3 :아산화 질소의 공명 구조
그러나 실제 구조는 그러한 구조의 하이브리드입니다.
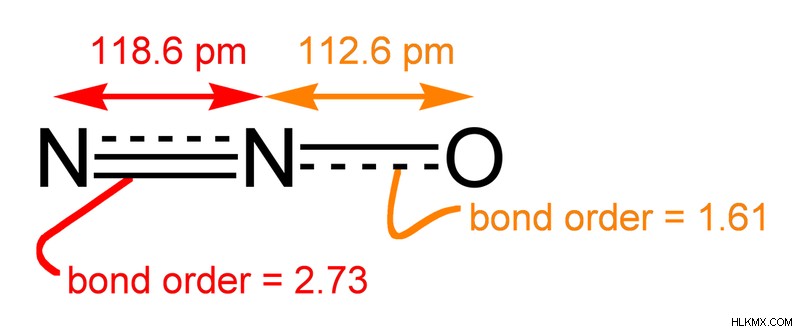
그림 4 :아산화 질소의 실제 구조
아산화 질소는 실온 및 압력에서 불활성 가스로 간주되며 화학 반응이 거의 없습니다. 그러나 온도가 증가하면 반응성도 증가합니다. 예를 들어, 187 ℃에서 아산화 질소는 NANH 2 와 반응한다. 나트륨 아 지드 생성 (NAN <<서브> 3 ).
아산화 질소에서 질소의 산화 상태는 +1입니다. 산소의 산화 상태는 -2이고 아산화 산화물 분자는 중성 화합물이다. 그런 다음 방정식의 균형을 잡으려면 두 질소 원자의 산화 상태가 +2이어야합니다.
아산화 질소의 산화 상태 =0
산소 원자의 산화 상태 =-2
따라서
n2o =2 (n) + (o)
0 =2 (n) + (-2)
2 (n) =+2
(n) =+1
산화 질소와 아산화 질소의 유사성
- 둘 다 실온과 압력에서 무색 가스입니다.
- 둘 다 질소와 산소 원자로 구성되어 있습니다.
- 둘 다 공유 화합물입니다.
산화 질소와 아산화 질소의 차이
정의
산화 질소 : 산화 질소는 화학적 공식 번호를 갖는 질소의 산화물입니다.
산화 질소 : 아산화 질소는 화학적 공식을 갖는 질소의 산화물입니다. n 2 o.
몰 질량
산화 질소 : 산화 질소의 몰 질량은 30 g/mol.
이다산화 질소 : 산화 질소의 몰 질량은 44 g/mol.
이다용융점 및 끓는점
산화 질소 : 산화 질소의 융점은 -164 ° C이고 끓는점은 -152 ° C입니다.
산화 질소 : 아산화 질소의 융점은 -90.86 ° C이고 끓는점은 -88.48 ° C입니다.
원자력
산화 질소 : 산화 질소의 원자력은 2.
입니다산화 질소 : 아산화 질소의 원자력은 3.
입니다질소의 산화 상태
산화 질소 : 산화 질소에서 질소의 산화 상태는 +2입니다.
산화 질소 : 아산화 질소에서 질소의 산화 상태는 +1입니다.
결론
질소는 주기율표의 그룹 5에서 비금속 화학 요소입니다. 많은 산화물 화합물을 형성 할 수 있습니다. 산화 질소 및 아산화 질소는 이러한 두 화합물입니다. 산화 질소와 산화 질소의 주요 차이점은 산화 질소의 질소는 산화 상태 +2를 갖는 반면, 산화 질소에서 질소의 산화 상태는 +1입니다.
.






