주요 차이 - 팔라듐 대 백금
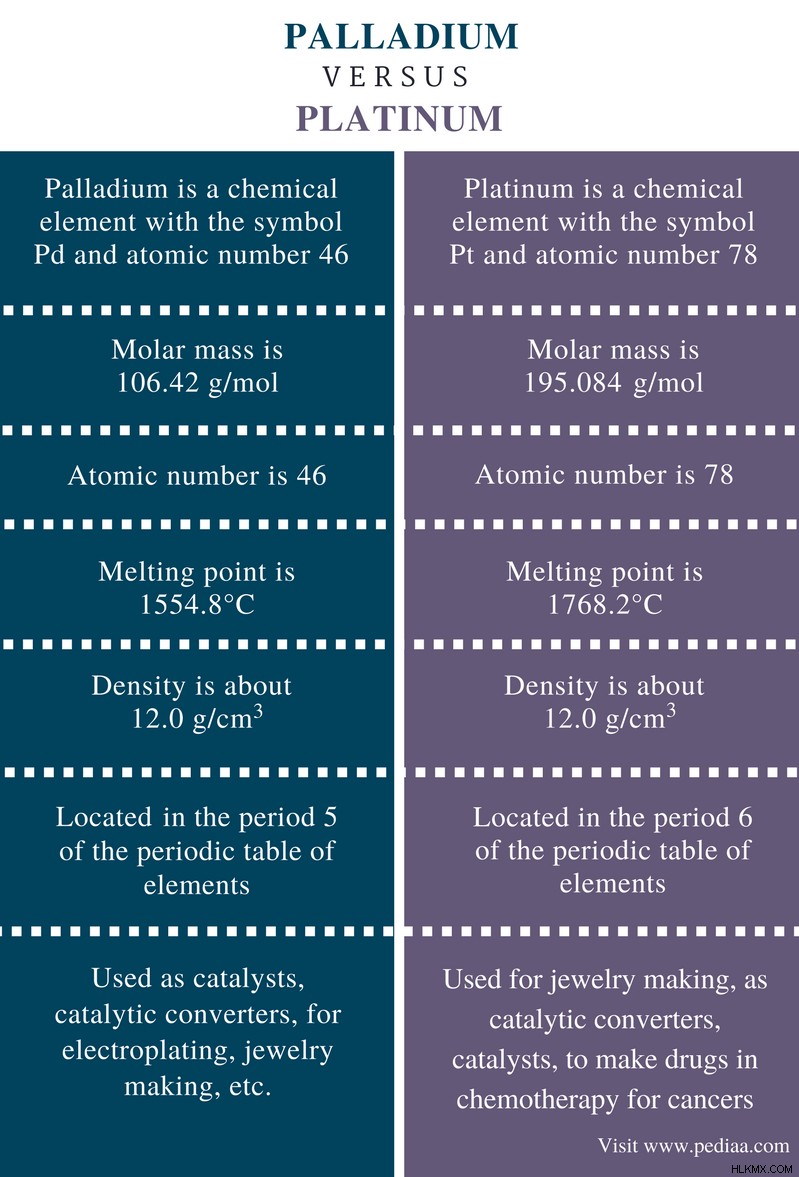
Palladium과 Platinum은 비슷한 외관 때문에 종종 혼란스러워합니다. 둘 다 반짝이는 은빛 화이트 금속입니다. 이 금속은 팔라듐, 로듐, 루테늄, 오스마늄, 이리듐 및 백금을 포함하는 백금 그룹 금속 (PGM)에 있습니다. 팔라듐과 백금은 모두 전이 금속이며 동일한 전기성이 있습니다. 그러나 그들의 화학적 특성은 서로 다릅니다. 팔라듐과 백금의 주요 차이점은 팔라듐이 PGM 요소들 사이에서 밀도와 용융점이 가장 적지 만 백금은 상당히 높은 밀도와 높은 융점을 가지고 있다는 것입니다.
주요 영역을 다루었습니다
1. 팔라듐이란?
- 정의, 화학적 특성, 사용
2. 플래티넘
- 정의, 화학적 특성, 사용
3. 팔라듐과 백금 의 차이점은 무엇입니까?
- 주요 차이점 비교
주요 용어 :산, 원자 수, 아쿠아 레지아, 부식성, 밀도, 녹는 점, 팔라듐, 백금, 백금 그룹 금속
팔라듐
Palladium은 pd 기호가있는 화학 요소입니다. 원자 번호 46. 반짝이는 은빛 흰색 금속입니다. 실온 및 압력에서는 고체 단계에 있습니다. 팔라듐은 일반 온도에서 공기와 산의 부식에 내성이 있습니다.
팔라듐의 화학적 특성
팔라듐의 일부 화학적 특성은 다음과 같습니다.
- 원자 번호 - 46
- 원자 질량 - 106.42 g/mol
- 전자 구성 - [KR] 4D
- 그룹 - 10
- 기간 - 5
- 블록 - D (전이 금속)
- 용융점 - 8 ° C
- 끓는점 - 2963 ° C
- 전기 음성 - 2.2 (Pauling Scale)
- 밀도 - 12.0 g/cm

그림 1 :팔라듐
palladium, Rhodium, Ruthenium, Osmium, Iridium 및 Platinum과 함께 백금 그룹 금속 라고합니다. (PGM). 팔라듐의 출현은 백금의 모양과 매우 유사합니다. 팔라듐은 백금 그룹 금속의 다른 화학 요소 중에서 밀도와 용융점이 가장 적습니다.
Palladium은 단위 셀이 큐브 모양 인 "얼굴 중심 입방"결정 구조를 가지고 있습니다. 팔라듐은 어느 정도 내식성이지만, 농축 질산, 황산 등과 같은 뜨거운 산에 의해 공격을 받는다. 팔라듐은 아쿠아 레지아 (질산과 염산의 혼합물)에 용해 될 수있다.
.Palladium은 표준 온도에서 산소와 반응하지 않기 때문에 공기에 노출 될 때 변색되지 않습니다. 그러나 황가 함유 된 촉촉한 대기에서 팔라듐은 가볍게 변색됩니다.
팔라듐의 응용
팔라듐의 응용에는 다음을 포함합니다.
- 촉매로 사용됩니다 (정밀하게 분할 된 팔라듐은 수소화, 탈수 형성 및 석유 크래킹 반응을 가속화하는 데 사용됩니다)
- 저전압 전기 접점에서 사용됩니다 (부식 저항으로 인해)
- 보석 제작 (“화이트 골드”라는 합금 형식-플래티넘이있는 합금)
- 시계 베어링, 과학기구, 스프링 등의 거울을 만들려면
- 자동차의 촉매 변환기로 사용됩니다 (자동차 배기 가스에서 배출량을 줄이기 위해)
- 전기 도금 (팔라듐 염이 사용됨)
플래티넘
플래티넘은 pt 기호가있는 화학 요소입니다. 그리고 원자 번호 78. 반짝이는 은빛 흰색 모양이 있습니다. 그것은 금과 같이 매우 반응하지 않으며 부식에 매우 저항력이 있습니다. 플래티넘은 백금 그룹 금속의 구성원입니다.
백금의 화학적 특성
백금의 일부 화학적 특성은 다음과 같습니다.
- 원자 번호 - 78
- 원자 질량 - 195.084 g/mol
- 전자 구성 - [xe] 4f5d6s
- 그룹 - 10
- 기간 - 6
- 블록 - D (전이 금속)
- 용융점 - 2 ° C
- 끓는점 - 3825 ° C
- 전기 음성 - 2.2 (Pauling Scale)
- 밀도 - 21.5 g/cm

그림 2 :백금
플래티넘은 충적 퇴적물에서 자유 금속으로 발견됩니다. 백금은 가장 반응성이 낮은 금속 중 하나입니다.
순수한 백금은 연성, 가단성 및 광택입니다. 금과은과 비교할 때 백금은 연성이지만 가단성이 떨어집니다. 백금은 농축 질산 및 염산과 반응하는 데 저항하지만 뜨거운 아쿠아 레지아 (질산과 염산의 혼합물)에 용해됩니다.
백금의 응용
백금의 일부 응용 프로그램은 다음과 같습니다.
- 보석류 (변조에 대한 강도와 저항으로 인해)
- 자동차, 트럭 및 버스의 촉매 변환기 (차량 엔진에서 배출량을 덜 유해한 폐기물로 변환하는 효율로 인해. )
- 질산, 실리콘 및 벤젠의 생산을위한 촉매로서
- 전극에 사용되는 와이어
- 의료 용도 (백금 화합물은 화학 요법 약물로 사용됩니다)
팔라듐과 백금의 차이
정의
팔라듐 : 팔라듐은 PD 및 원자 번호 46을 가진 화학 요소입니다.
플래티넘 : 플래티넘은 PT 기호와 원자 번호 78을 갖는 화학 요소입니다.
원자 번호
팔라듐 : 팔라듐의 원자 수는 46입니다.
플래티넘 : 백금의 원자 수는 78입니다.
원자 질량
팔라듐 : 팔라듐의 원자 질량은 106.42 g/mol.
입니다플래티넘 : 백금의 원자 질량은 195.084 g/mol
입니다용융점
팔라듐 : 팔라듐의 융점은 1554.8 ° C입니다.
플래티넘 : 백금의 용융점은 1768.2 ° C입니다
밀도
팔라듐 : 팔라듐의 밀도는 약 12.0 g/cm입니다.
플래티넘 : 팔라듐의 밀도는 약 21.5 g/cm입니다.
기간
팔라듐 : 팔라듐은주기적인 요소 테이블의 5 기간에 있습니다.
플래티넘 : 플래티넘은주기적인 요소 테이블의 6 기간에 있습니다.
사용
팔라듐 : 팔라듐은 촉매, 촉매 변환기, 전기 도금, 보석 만들기 등으로 사용됩니다.
플래티넘 : 플래티넘은 촉매 변환기, 촉매제로서 암을위한 화학 요법 약물을 만드는 보석 제작에 사용됩니다.
결론
Palladium과 Platinum은 비슷한 외관을 가진 매우 중요한 금속입니다. 이 금속에는 다양한 응용이 있습니다. 비슷하게 보이지만 그들 사이에는 많은 화학적 차이가 있습니다. 팔라듐과 백금의 주요 차이점은 팔라듐이 PGM 요소들 사이에서 밀도와 용융점이 가장 적지 만 백금은 상당히 높은 밀도와 높은 융점을 가지고 있다는 것입니다.
참조 :
1.“Palladium - 요소 정보, 속성 및 용도 | 주기적 테이블.” Royal Society of Chemistry, 여기에서 구할 수 있습니다.
2.“수처리 솔루션.” Lenntech 수처리 및 정제, 여기에서 구할 수 있습니다.
3.“플래티넘 - 요소 정보, 속성 및 용도 | 주기적 테이블.” 왕립 화학 학회, 여기에서 이용 가능.
이미지 제공 :
1. 화학 요소의 고해상도 이미지에 의한“팔라듐 (46 PD)”-Commons Wikimedia
2를 통해 (CC x 3.0)“Platinum (러시아) 3 (17151299739)”James St. John-Platinum (2.0) 3 (CC x 2.0) Wikimedia